蛋白质磷酸化
日期:2024-02-02 16:01:07
蛋白质磷酸化是蛋白质中特定氨基酸残基上磷酸基团的可逆添加,是一种基本的翻译后修饰(PTM),可调控多种细胞过程。本文全面概述了蛋白质磷酸化,包括其机制、相关酶以及对蛋白质结构、功能和细胞信号通路的深远影响。
1. 什么是蛋白质磷酸化?
蛋白质磷酸化是在特定氨基酸残基上共价添加磷酸基团,是细胞信号传导和控制的关键调节机制。它使细胞能够对环境线索做出快速反应,并调节各种生物过程。
2. 磷酸化机制
蛋白质磷酸化是指将磷酸基团从 ATP 转移到蛋白质中特定的氨基酸残基上 [1]。最常见的磷酸化位点是丝氨酸、苏氨酸和酪氨酸残基,但组氨酸和天冬氨酸等其他残基也可被磷酸化。这一过程由称为激酶的酶催化,激酶将磷酸基团转移到目标蛋白质上。相反,蛋白磷酸酶会催化磷酸化蛋白质上的磷酸基团脱落,从而逆转磷酸化过程。
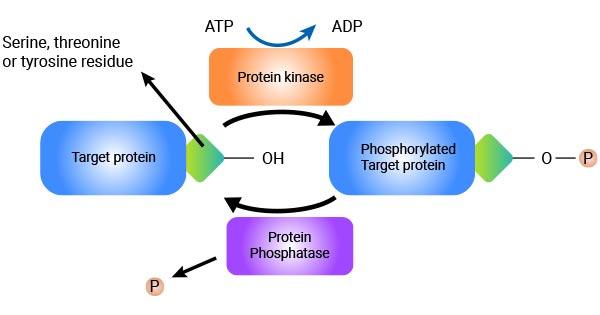
图1. 蛋白质磷酸化作用机制
2.1 蛋白激酶
磷酸化是激活蛋白激酶的关键机制,可启动一系列事件,最终导致不同氨基酸的磷酸化 [4]。激酶的激活或失活可通过多种机制发生,包括激酶本身的顺式磷酸化/自磷酸化、与激活剂或抑制剂蛋白结合或检查它们在细胞中与底物的定位关系 [5]。
据估计,多达 30% 的人类蛋白质都是通过激酶活性进行修饰的,这凸显了激酶在调节细胞通路方面的广泛作用和影响。值得注意的是,激酶在调节信号转导方面起着至关重要的作用,管理着细胞通讯和反应中的大多数细胞通路 [6]。
蛋白激酶是一组催化目标蛋白磷酸化的多种酶。激酶通过调节蛋白质活性、蛋白质与蛋白质之间的相互作用以及下游信号级联的启动,在细胞信号传导中发挥着关键作用。根据其磷酸化的氨基酸残基,激酶可分为多个家族。
以下是几大类蛋白激酶:
| 分类 | 成员 | 功能 | |
|---|---|---|---|
| Serine/Threonine Protein Kinases (STKs) | AGC | PKA, PKG, PKC, Akt/PKB, S6 Kinase (S6K), RSK (Ribosomal S6 Kinase), MSPK1, MSPK2, PDK1, PKD, GRK1, GRK2, GRK3, GRK4, GRK6, GRK7, GRK8 | 参与多种细胞过程,包括新陈代谢、细胞周期调控和神经元信号传导。 |
| Cyclin-dependent kinases (CDKs) | CDK1, CDK2, CDK3, CDK4, CDK5, CDK6, CDK7, CDK8, CDK9, CDK10, CDK11, CDK11A, CDK11B, CDK12, CDK13, CDK14, CDK15, CDK16, CDK17, CDK18, CDK19, CDK20 | CDK 在细胞周期调控网络中起着核心作用,其主要生物学作用是调控细胞周期的不同阶段,从 G1、S、G2 到 M 期,并完成整个周期。它们还参与调控神经细胞的转录、mRNA 处理和分化。 | |
| CAMK | CAMK1, CAMK2A, CAMK2B, CAMK2G, CAMK2D, CAMK4, CAMK1L1/MARK1, CAMK1L2/ARK5, CAMK1L3/MARK2, CAMK1L4/SNRK, CAMK1L5/MARK3, CAMK1L6/MARK4 | CAMK受Ca2+和钙调素的结合调节,在神经元信号传导、肌肉收缩和突触可塑性中发挥重要作用。 | |
| CK1 (casein kinase 1) | CK1α/CSNK1A1, CK1β/CSNK1B, CK1γ/CSNK1G1, CK1δ/CSNK1D, CK1ε/CSNK1E, CK1γ/CSNK1G1, CK1ε/CSNK1E | 参与多种细胞过程,包括昼夜节律调节、Wnt信号传导、囊泡运输和DNA 修复。 | |
| MAPK | ERK1/MAPK3, ERK2/MAPK1, ERK3/MAPK6, ERK4/MAPK4, ERK5/MAPK7, JNK1/MAPK8, JNK2/MAPK9, JNK3/MAPK10, p38α/MAPK14, p38β/MAPK11, p38γ/MAPK12, p38δ/MAPK13 | 细胞对细胞外刺激(如生长因子、压力和细胞因子)反应的关键调节因子。它们参与各种生物过程,包括细胞增殖、分化、存活、应激反应和免疫调节。 | |
| Tyrosine Protein Kinases (TKs) | Receptor Tyrosine Kinases (RTKs) | EGFR/ErbB1/HER1, ErbB2/HER2, ErbB3/HER3, ErbB4/HER4, insulin receptor (IR), IGF1R, FGFR1, FGFR2, FGFR3, FGFR4, PDGFRA, PDGFRB, VEGFR1/Flt1, VEGFR2/KDR/Flk1, VEGFR3 /Flt4, HGFR, KIT/CD117, RET, EphA1, EphA2, EphA3, EphA4, EphA5, EphB1, EphB2, EphB3, EphB4, EphB6, ALK | RTK在细胞生长、分化和存活过程中发挥着至关重要的作用。它们通过配体结合激活,包括生长因子、细胞因子和激素的受体。 |
| Non-receptor Tyrosine Kinases (NRTKs) | Src, Yes, Fyn, Lck, Lyn, Blk, Hck, Abl1, Abl2, Tec, Btk, Itk, Bmx, JAK1, JAK2, JAK3, Tyk2, Syk, ZAP70, Fer, Fes | 参与细胞内信号传导途径,调节细胞增殖、迁移和免疫反应等过程。 | |
| Dual-Specificity Kinases | MAPK Kinases (MAPKKs) or MEKs | MAP2K1/MEK1, MAP2K2/MEK2, MAP2K3/MKK3, MAP2K4/MKK4, MAP2K5/MKK5, MAP2K6/MKK6, MAP2K7/MKK7, MAP2K8/MKK8, MAP2K9/MKK9, MAP2K10/MKK10, MAP2K11/MKK11 | MAPKK磷酸化并激活MAPK,进而调节各种细胞过程,包括细胞增殖、分化、凋亡和应激反应。 |
| Dual-Specificity Tyrosine-Regulated Kinases (DYRKs) | DYRK1A, DYRK1B, DYRK2, DYRK3, DYRK4 | DYRKs磷酸化丝氨酸/苏氨酸和酪氨酸残基,参与各种细胞过程,包括发育、细胞周期调节和神经元功能。 | |
2.2 蛋白磷酸酶
磷酸酶的功能与激酶相反。它们就像 "分子剪刀",将磷酸单酯切割成一个磷酸基团和一个带有游离羟基的分子 [7][8],从而逆转磷酸化过程。
磷酸酶在终止信号传导、重置蛋白质活性和维持细胞稳态方面发挥着至关重要的作用。根据催化亚基和底物特异性,磷酸酶可分为多个家族。以下是蛋白磷酸酶的主要类别及其相应功能:
| 分类 | 功能 | ||
|---|---|---|---|
| Protein Tyrosine Phosphatases (PTPs) | Receptor-type PTPs | PTPRC/CD45, PTPRF, PTPRO, PTPRT | PTPs 可使蛋白质中的酪氨酸残基去磷酸化。它们在细胞信号传导中发挥着重要作用,包括受体酪氨酸激酶信号传导、生长因子信号传导和细胞粘附调节以及细胞周期进展控制。PTPs 参与调控多种细胞过程,如细胞生长、分化和免疫反应。 |
| Non-receptor-type PTPs | PTPN1/PTP1B, PTPN2/TCPTP, PTPN11/SHP2, DUSP3/VHR | ||
| Serine/Threonine Phosphatases (STPs) | phosphoprotein phosphatases (PPPs) | Protein Phosphatase 1 (PP1), PP2A, PP2B, PP4, PP5, PP6, PP7 | PPPs 可调节糖原代谢、细胞周期进展、基因表达、蛋白质合成等细胞过程、 钙依赖性信号通路、免疫反应、肌肉收缩和神经元功能。PPMs 的催化活性需要镁或锰等二价金属离子。它们参与多种细胞过程,包括细胞周期调节、DNA 损伤反应和细胞应激反应。 |
| metallo-dependent protein phosphatases (PPMs) | PPM1A, PPM1X, PP2C | ||
| Dual Specificity Phosphatases (DSPs) | DUSP1/MKP-1, DUSP6/MKP-3, VHR/DUSP3 | DSPs 是一类蛋白磷酸酶,能使目标蛋白中的磷酸酪氨酸和磷酸丝氨酸/磷酸苏氨酸残基去磷酸化。它们调节各种信号通路,包括 MAPK 信号、细胞周期进展和免疫反应。 |
|
| Aspartate-Based Phosphatases | Haloacid Dehalogenase (HAD) superfamily phosphatases | PPM1A, PPM2 | 天冬氨酸磷酸酶是一类能使目标蛋白质中的天冬氨酸残基去磷酸化的蛋白磷酸酶。它们参与调控细菌双组分信号系统,该系统在细菌应对环境变化的过程中发挥着关键作用。 |
| Cysteine-Based Protein Phosphatases (CBPs) | CPTP/PTPN22, LMPTP/ACP1 | 它们使酪氨酸磷酸化蛋白去磷酸化,负责调节细胞周期进程、细胞应激反应、细胞生长和分化以及维持蛋白质平衡。 | |
3. 蛋白质磷酸化及其结构
3.1 构象变化和蛋白质动力学
磷酸化可诱导蛋白质构象变化,改变其结构并调节其功能[2]。这些结构修饰可影响蛋白质与蛋白质之间的相互作用、蛋白质的稳定性、亚细胞定位和酶活性。磷酸化可充当分子开关,在各种刺激下将蛋白质 "打开 "或 "关闭"。
磷酸化事件可为含有特定磷酸化识别域的蛋白质创建结合位点,从而影响蛋白质之间的相互作用。这有利于蛋白质复合物的组装和下游信号元件的招募,从而扩大和传播信号级联。
3.2 异构调节
磷酸化可通过异构机制调控蛋白质功能[3]。磷酸基团在特定位点的添加或移除可诱导蛋白质远端区域的构象变化,从而改变其活性或对配体的亲和力。这种异构调节可对细胞反应和信号放大进行微调。
3.3 酶的激活和抑制
磷酸化在调节酶活性方面起着至关重要的作用。它可以通过直接调节酶的催化位点或改变酶与底物或辅助因子的相互作用来激活或抑制酶。例如,丝氨酸/苏氨酸激酶的磷酸化可导致激活,而酪氨酸激酶的磷酸化可导致抑制。
4. 信号转导中的蛋白质磷酸化
磷酸化起着分子开关的作用,触发一连串事件,将信号从细胞外环境传递到细胞核或其他细胞区,从而导致特定的细胞反应。它可以改变磷酸化蛋白的构象、活性、亚细胞定位和相互作用伙伴,从而调节其功能和下游信号转导。
4.1 RTK 信号通路
受体酪氨酸激酶(RTK)通过将细胞外信号转导为细胞内反应,在细胞通讯中发挥着重要作用。配体与 RTK 结合会引发受体二聚化和自身磷酸化,从而激活下游信号通路。受体中的磷酸化酪氨酸残基可作为适配蛋白和下游效应因子的对接位点,从而启动各种信号级联。
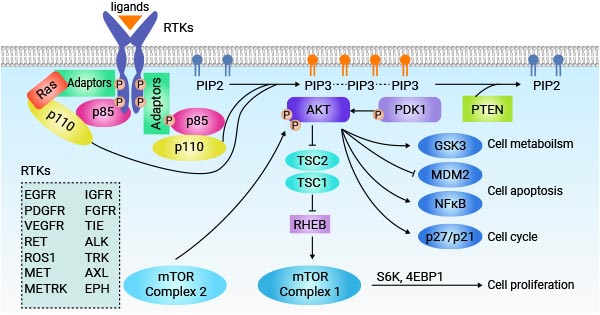
图2. RTK signaling pathway
图片来源:https://www.sciencedirect.com/science/article/abs/pii/S1044579X18301172
4.2 G蛋白偶联受体信号传导途径
GPCR 信号途径始于配体与细胞表面的 GPCR 结合。这将激活受体,使其构象发生变化。激活的 GPCR 随后与 G 蛋白相互作用,导致 α 亚基与 βγ 亚基分离。
α亚基和βγ亚基独立调节下游效应器,启动细胞内信号级联。这些级联产生的第二信使可放大信号并激活蛋白激酶等下游效应物,最终调节细胞过程,包括基因表达、离子通道活性、神经递质释放和细胞代谢。
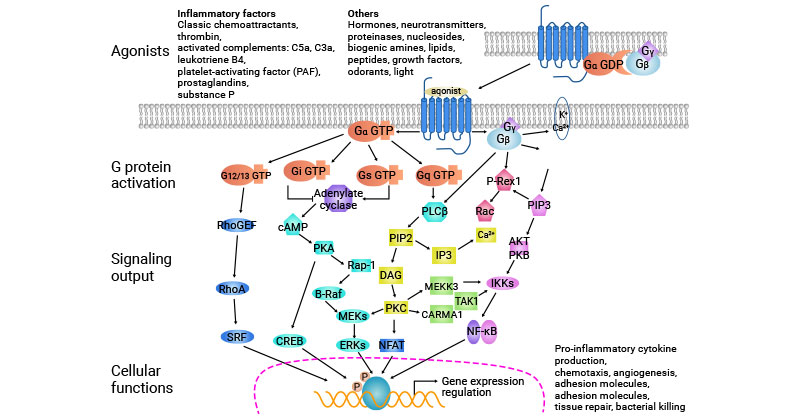
图3. GPCR signaling pathway
图片来源:https://www.nature.com/articles/aps2011200
4.3 MAPK信号通路
MAPK通路是一种由蛋白质磷酸化调控的特征明显的信号级联。MAPK通过连续的磷酸化事件被激活,从而导致下游效应因子(如转录因子)的激活。该途径参与多种细胞过程,包括细胞增殖、分化和对细胞外信号的反应 [9]。
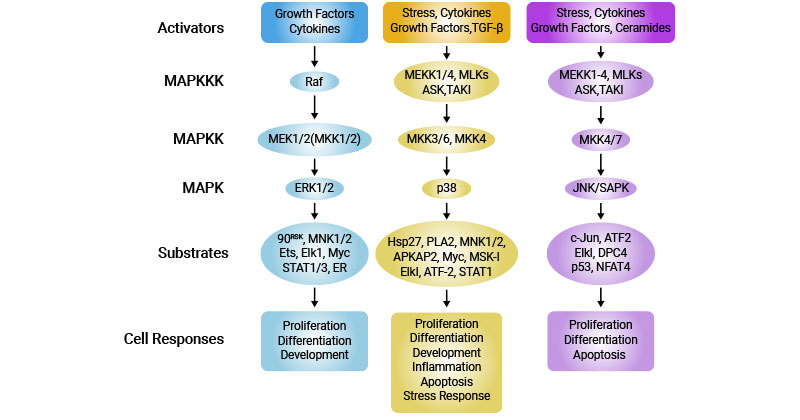
图4. 哺乳动物细胞中的主要MAP激酶级联
图片来源:https://www.nature.com/articles/7290105
5. 蛋白质磷酸化与细胞周期调控
细胞周期是一个控制细胞分裂和增殖的高度调控过程,它受到蛋白质磷酸化的严格控制。细胞周期蛋白依赖性激酶(CDKs)及其调控亚基--细胞周期蛋白--协调着细胞周期不同阶段的进展。CDK 及其底物的磷酸化可调节细胞周期检查点的顺序激活,并确保遗传物质的准确复制和分裂。
5.1 磷酸化与细胞周期检查点
磷酸化在细胞周期检查点中起着至关重要的作用,细胞周期检查点是确保 DNA 完整性和防止受损细胞繁殖的监控机制。特定检查点的磷酸化事件可调节细胞周期进程的激活或抑制,从而为 DNA 修复留出时间,或在无法修复时触发细胞程序性死亡。
5.2 对有丝分裂的调控
磷酸化事件还调控细胞分裂过程--有丝分裂。蛋白质磷酸化可协调有丝分裂纺锤体的组装和解体、染色体的凝集和分离以及有丝分裂的进入和退出时间。有丝分裂磷酸化失调可导致细胞分裂异常和基因组不稳定。
6. 蛋白质磷酸化与基因表达
蛋白质磷酸化影响转录调控、染色质重塑、mRNA 加工和稳定性。蛋白质磷酸化是信号通路和基因表达程序之间的动态连接,确保基因表达模式在响应细胞和环境线索时受到精确且与环境相关的控制。
6.1 转录因子
磷酸化可调节转录因子的活性,转录因子是通过与特定 DNA 序列结合来控制基因表达的蛋白质。磷酸化事件可调节转录因子的 DNA 结合亲和力、亚细胞定位、稳定性和转录活性,从而影响目标基因的表达。
6.2 染色质重塑
磷酸化还能调节染色质结构和转录机制的可及性。构成核小体核心的组蛋白可被磷酸化,从而导致染色质压实的改变和染色质重塑复合物的招募。这些变化可促进或抑制基因转录。
6.3 RNA聚合酶
调节磷酸化事件可调节RNA聚合酶的活性,该酶负责在转录过程中从DNA模板合成RNA。RNA聚合酶II C端结构域的磷酸化会影响其与转录因子的相互作用以及其他转录机制的招募,最终影响转录输出。
7. 蛋白质磷酸化的调控
蛋白质磷酸化的调控涉及激酶、磷酸酶、调节蛋白和信号通路之间复杂的相互作用。这种动态调控确保了对磷酸化事件的精确控制,使细胞能够对环境线索做出反应,维持细胞平衡,并协调适当的生理过程。
7.1 激酶的激活与抑制
激酶和磷酸酶活性之间的平衡密切调节着磷酸化事件。各种机制,如其他信号分子的激活或抑制、亚细胞定位以及蛋白质与蛋白质之间的相互作用,都会影响激酶和磷酸酶的活性。这些酶的失调可导致异常磷酸化,并引发疾病。
7.2 支架蛋白和适配体
支架蛋白和适配体在协调信号通路中的磷酸化事件方面发挥着至关重要的作用。它们将信号级联的多个成分结合在一起,促进有效的磷酸化并促进信号传播。支架蛋白还有助于磷酸化事件的特异性和空间组织。
7.3 相互影响和反馈回路
磷酸化事件的发生往往与环境有关,不同信号通路和反馈回路之间存在串扰。通路之间的串联可整合多种信号,而反馈回路则可微调信号输出,并为细胞反应提供稳健性。这些调控机制可实现对细胞信号的精确控制和适应。
8. 疾病中的蛋白磷酸化失调
蛋白质磷酸化失调是许多疾病的共同特征,导致细胞信号传导、新陈代谢和功能发生病理变化。
8.1 癌症
蛋白磷酸化失调是癌症的特征之一。激酶和磷酸酶的异常激活或失活,以及磷酸化位点或调控蛋白的突变,可导致细胞增殖失控、逃避凋亡和转移 [10]。针对特定的磷酸化事件或信号通路已成为癌症治疗中一种很有前景的治疗策略。
8.2 神经退行性疾病
蛋白质磷酸化异常与阿尔茨海默病、帕金森病和亨廷顿病等神经退行性疾病有关。在这些疾病中,激酶活性失调、tau 蛋白磷酸化改变以及信号通路受损都会导致神经元功能障碍和细胞死亡。
8.3 代谢紊乱
蛋白质磷酸化紊乱会导致代谢紊乱,包括糖尿病和肥胖症。磷酸化事件调节胰岛素信号、葡萄糖代谢、脂质平衡和能量平衡。这些过程的失调可导致胰岛素抵抗、葡萄糖摄取受损和脂质代谢改变。
9. 以蛋白质磷酸化为靶点进行治疗干预
靶向蛋白磷酸化已成为治疗干预各种疾病的一种有前途的策略。通过操纵蛋白激酶和磷酸酶的活性,调节细胞信号通路,恢复细胞的正常功能。
9.1 激酶抑制剂
药物研究的重点是开发激酶抑制剂作为靶向治疗药物。选择性靶向特定激酶的小分子抑制剂在治疗某些类型的癌症和以磷酸化失调为特征的其他疾病方面取得了成功。然而,靶向选择性、耐药性和脱靶效应等挑战仍有待解决。
9.2 磷酸酶调节
调节磷酸酶的活性是另一种潜在的治疗干预途径。然而,由于磷酸酶催化结构域的高度保守性,开发磷酸酶特异性调节剂面临巨大挑战。
9.3 挑战与未来展望
尽管靶向蛋白质磷酸化通路为治疗干预带来了希望,但仍有一些挑战需要解决。这些挑战包括了解信号网络的复杂性、提高靶点选择性和疗效、克服耐药性以及开发特异性递送和组织靶向策略。蛋白质组学、高通量筛选和计算建模等技术的进步将不断加深我们对蛋白质磷酸化的理解,并为新型治疗方法铺平道路。
总之,蛋白质磷酸化是一个动态和高度调控的过程,在细胞信号传导和调控中发挥着核心作用。它影响蛋白质的结构、功能以及蛋白质与蛋白质之间的相互作用,从而控制信号转导、细胞周期调控、基因表达和细胞反应等多种生物过程。
我们对蛋白质磷酸化及其错综复杂的信号通路网络的理解不断进步,这将继续揭示细胞生物学和疾病机制的复杂性。要破译完整的磷酸化蛋白质组、确定新的靶点并开发创新的治疗策略,还需要进一步的研究和技术进步。利用蛋白质磷酸化的力量具有巨大的潜力,可以促进我们对人类健康和疾病的了解,最终改进诊断和靶向治疗。
参考文献:
[1] Ubersax JA, Ferrell JE. Mechanisms of specificity in protein phosphorylation [J]. Nature Reviews Molecular Cell Biology. 2007;8(7):530–541.
[2] Eli S Groban, Arjun Narayanan, and Matthew P Jacobson. Conformational Changes in Protein Loops and Helic [J]. PLoS Comput Biol. 2006 Apr; 2(4): e32.
[3] Pincus D, Pandey JP, et al. Evolution and Engineering allosteric regulation in protein kinases [J]. Sci Signal. 2018 Nov 6;11(555):eaar3250.
[4] Alberts B, Johnson A, et al. Molecular Biology of the Cell. Anderson M and Granum S: 5th edition [J]. Garland Science; New York, NY: pp. 1752007
[5] Roskoski R Jr. ERK1/2 MAP kinases: structure, function, and regulation [J]. Pharmacol Res. 66:105–143. 2012.
[6] McCance KL and Huether SE. Pathophysiology: The Biologic Basis for Disease in Adults and Children [J]. Brashers VL and Rote NS: 7th edition. Elsevier; 2014.
[7] Barford D. Molecular mechanisms of the protein serine/thre-onine phosphatases [J]. Trends Biochem Sci. 21:407–412. 1996.
[8] Zhang ZY. Protein tyrosine phosphatases: structure and function, substrate specificity, and inhibitor development [J]. Annu Rev Pharmacol Toxicol. 42:209–234. 2002.
[9] Chang L and Karin M. Mammalian MAP kinase signalling cascades [J]. Nature. 410:37–40. 2001.
[10] Harsha HC and Pandey A. Phosphoproteomics in cancer [J]. Mol Oncol. 4:482–495. 2010.
上一篇: 蛋白质翻译后修饰(PTM)











