肌球蛋白调节轻链(MYL12A和MYL12B):CD69的新功能配体,心脏、肿瘤等多疾病研究潜力靶点?
日期:2024-01-26 09:48:47
肌球蛋白调节轻链(MLCs)是肌动蛋白II的重要组成部分,在肌肉收缩运动、细胞分裂等多种生命活动中发挥重要作用。近年来,研究发现MLCs存在多种亚型,包括MYL9,MYL12A和MYL12B,且具有高度同源性。其中,MYL12A和MYL12B与肌动蛋白重链结合形成肌动蛋白复合物,共同参与调控细胞运动等过程。此外,它们的磷酸化状态可影响肌动蛋白复合物的活性,从而调节肌肉收缩强度、细胞运动速度等。新近研究发现,MYL12A和MYL12B在多种疾病中扮演重要角色,其磷酸化水平与心脏疾病(eg.心肌损伤、心肌肥厚)和癌症相关。因此,MYL12A和MYL12B有望作为重要的生物学标志物,成为心脏、肿瘤等多种疾病的研究潜力靶点!
1. 什么是肌球蛋白调节轻链(Myosin Regulatory Light Chain,MRLC)?
肌球蛋白包括多个组成部分,其中包括肌球蛋白重链(Myosin Heavy Chain)和肌球蛋白轻链(Myosin Light Chains)(点击查看什么是肌球蛋白家族?)。肌球蛋白轻链又分为基础性MLC(MLC I)和调节性MLC(MLC II)或(Myosin regulatory light chain,MRLC),其中MHC是运动域,而MLC I起到稳定MHC结构的作用,MLC II主要调节肌球蛋白的活性。根据MRLC的氨基酸序列,可以将其分为两大类:I类MRLC是肌肉中主要存在的RLC,包括MLC1、MLC2、MLC3、MYL4,MYL5, MYL6, MYL7等。II类MRLC在非肌肉细胞中也存在,包括MYL9、MYL12A、MYL12B等。I类和II类的结构相似,但其磷酸化位点不同,前者主要在Ser19位点被磷酸化,而后者在Ser17位点被磷酸化 [1-4]。
2. MYL12A和MYL12B是什么?
肌球蛋白调节轻链12A(MYL12A,别称:MLCB;MRLC3;RLC)和肌球蛋白调节轻链12B(MYL12B,别称: MRLC2;MYLC2B;MLC2;MLC-2A;MLC-2),属于调节性MLC(MLC II)。肌球蛋白调节轻链与肌球蛋白重链的头部区域结合,并通过磷酸化调节肌球蛋白的活性。不管肌球蛋白的来源如何,每个类别都具有N端运动域、"颈部"杠杆臂、C末端尾巴。N端运动域的主要功能是与肌动蛋白分子结合,形成特定的结构。杠杆臂则由1到6个异亮氨酸-谷胺酷胺(isoleucine-glutamine,IQ)基序组成,通过与钙调蛋白的结合,引起运动域的构象变化,实现功能的放大。相比之下,C末端尾巴呈现出最大的多样性,广泛参与不同蛋白质之间的相互作用,充当重要的调控热点 [5-7] (图1)。
MYL12A和MYL12B是两种相似的调节轻链,尽管它们的氨基酸序列相似,但它们的表达和功能略有不同。MYL12A主要在平滑肌中表达,而MYL12B则广泛分布在多种组织中,包括骨骼肌 [7-11]。此外,它们的ATP酶活性也不同,MYL12A的活性较低,导致肌肉收缩较慢,而MYL12B的活性较高,使肌肉收缩速度更快 [8-12]。研究表明MYL12B是丝氨酸/苏氨酸激酶的底物,在MAPK激活下发挥关键作用,参与肌肉收缩和非肌肉细胞中肌动蛋白(actin)纤维化等生物学过程 [12-15]。
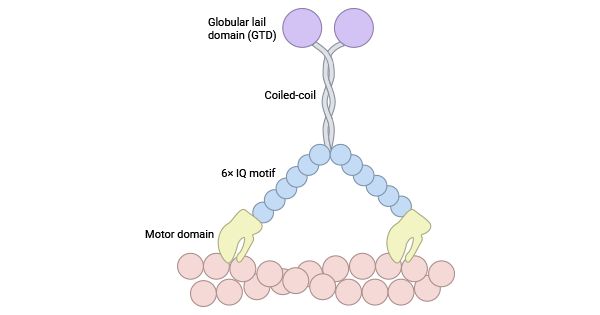
图1. 肌动蛋白II结构 [7]
3. MYL12A和MYL12B相关的配体是什么?
最新的研究发现,肌球蛋白轻链MYL12(MYL12A、MYL12B)和MYL9是CD69的新功能配体。在卵清蛋Ovalbumin(OVA)和屋尘螨诱导的小鼠哮喘模型中,阻断CD69-MYL9/12相互作用可改善过敏性气道炎症。气道炎症时,MYL9/12蛋白主要在血管腔表面被检测到,在血管内也以网状结构存在。特异性抗体阻断CD69与MYL9/12之间的相互作用,导致白细胞浸润减少,气道炎症改善,这表明MYL9/12将表达CD69的白细胞募集到炎性组织中起重要作用。此外,对嗜酸性粒细胞慢性鼻窦炎(Chronic Rhinosinusitis,CRS)患者鼻息肉的分析显示,MYL9/12表达在炎性病变中增加。该研究将MYL12A、MYL12B、MYL9确定为CD69的先前未知的功能性配体,其CD69-MYL9/12相互作用是活化的CD69+T细胞募集到炎症组织的关键事件,可能是难治性气道炎性疾病的治疗靶点 [16-18]。
4. 肌球蛋白轻链MYL12A和MYL12B相关的调控机制
肌球蛋白功能的发挥主要与肌球蛋白轻链的磷酸化和去磷酸化有关。肌球蛋白轻链磷酸化主要受两种激酶系统的调节,即肌球蛋白轻链激酶(myosin light chain kinase,MLCK)系统和Rho激酶(rhokinase,ROCK)系统。现有的研究表明,细胞内多条信号通路通过调节MYL12A和MYL12B的磷酸化和去磷酸化来调节细胞骨架的重塑和细胞的移动,但目前对其作用机制的认识仍十分有限,有待进一步探索。这里简单阐明肌球蛋白轻链激酶(myosin light chain kinase,MLCK)系统和Rho激酶(rhokinase,ROCK)系统这两个重要的相关机制 [19-23]。
4.1 肌球蛋白轻链激酶系统(MLCK)
MLCK是肌球蛋白轻链磷酸化的重要调节蛋白,由4种不同的激酶MLCK1/sm MLCK,MLCK2,MLCK3和MLCK4组成。MLCK是钙依赖性蛋白激酶,当细胞内Ca2+浓度升高,Ca2+与钙调蛋白结合,MLCK激活,使MLC II的Ser19和Thr18发生磷酸化,导致肌球蛋白头部的ATP酶激活,该ATP酶水解ATP,引发肌动蛋白和肌球蛋白相互作用,从而调节肌球蛋白参与的诸多生物学功能。另外,MLCK对肌球蛋白轻链的磷酸化存在非钙依赖性。有实验证明,高浓度的MLCK在无Ca2+/钙调蛋白存在的情况下,也能使MLC磷酸化,其原因与高浓度的MLCK自动磷酸化有关。但MLCK对肌球蛋白轻链的依赖性磷酸化是主要的调节途径(图2)[22]。
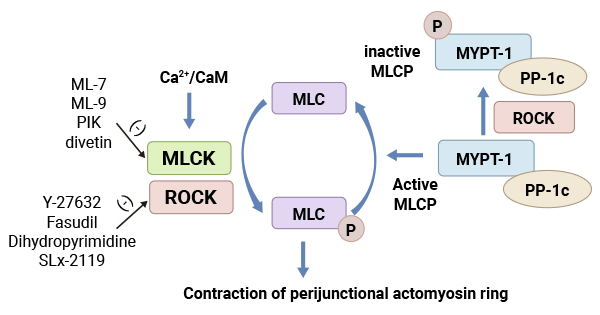
图2. 肌球蛋白轻链激酶系统(MLCK)[22]
4.2 Rho激酶系统
ROCK属于丝氨酸/苏氨酸蛋白激酶。在哺乳动物细胞中,ROCK包括2种亚型ROCKI和ROCKII。Rho是Rho激酶的上游激活蛋白,是Ras超家族成员之一,因具有GTP酶活性,又称为Rho GTP酶(如 RhoA,Racl和Cde42)。ROCK接受Rho传递的活化信号,发生多个氨基酸位点的磷酸化而激活,并介导其下游一系列磷酸化/脱磷酸化反应。肌球蛋白磷酸酶是其活化的底物,它接受Rho/Rho激酶的活化信号而使调节亚基发生磷酸化,最终导致自身失活,失活的肌球蛋白磷酸酶不能将肌球蛋白轻链MLC脱磷酸化,使得细胞质内MLC磷酸化水平增加,促进肌动蛋白和肌球蛋白相互作用(图3)[23]。
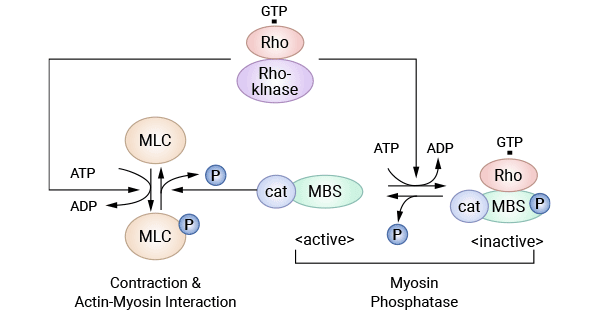
图3. Rho激酶系统 [23]
5. MYL12A和MYL12B在疾病中的研究
肌球蛋白作为细胞骨架蛋白,通过对其轻链磷酸化和去磷酸化的调节,参与细胞多种功能活动,并与多种疾病的发生发展密切相关。然而,目前关于MYL12A和MYL12B在疾病中的研究报道有限,一些研究表明MYL12A和MYL12B在心脏疾病、癌症、肠道屏障功能、缺血性脑病等疾病相关。
5.1 MYL12A和MYL12B与心脏相关疾病的研究
在扩张型心肌病方面,MRLC(MYL12A和MYL12B)磷酸化水平的降低与心脏扭转、心肌功能障碍以及扩张型心肌病的症状有关。关于肥厚型心肌病的研究表明,MYLK3基因敲除或突变与心肌肥厚有关,而MRLC的磷酸化水平的降低可能参与了肥厚型心肌病的发生。此外,对心力衰竭的研究发现MYLK3基因敲除小鼠在心功能方面出现失代偿,而心力衰竭患者中也观察到MYL2磷酸化水平明显下降,提示MRLC磷酸化水平的降低在心力衰竭的发生中发挥了作用,可能与肥厚型和扩张型心肌病有关。总的来说,这些研究结果强调了MRLC磷酸化在心脏疾病发生和发展中的重要作用 [24-28]。
5.2 MYL12A和MYL12B与肠道屏障研究
以往的研究表明,肠道屏障破坏导致的细菌渗透会促使病原体相关分子模式与模式识别受体(如TLR4、TLR和NLRP3)结合,激活免疫细胞产生免疫反应并分泌细胞因子,如IL-13和IFN-γ。研究还发现,过量的IFN-γ分泌可能增加细胞旁通透性,其中MLCK通路的激活参与了这一过程。然而,在急性胰腺炎(AP)中,MLCK/p-MLC2通路在肠屏障功能障碍中的确切作用尚不明确。一项研究表明,在AP时,回肠组织中的MLCK和P-MLC2蛋白表达水平显著增加,尤其是在模型后的24小时内,这表明在急性胰腺炎中,肠道中MLCK激活,MLC2磷酸化,MLCK/p-MLC2通路可能参与了肠屏障功能障碍 [35-36]。
5.3 MYL12A和MYL12B与癌症研究
研究表明,肌球蛋白轻链是重要的肿瘤标记性分子,通过对肌球蛋白轻链的磷酸化和去磷酸化的调节,影响肌球蛋白的活性,对肿瘤的增殖、侵袭和迁移发挥重要作用 [29]。MYPT1是肌球蛋白磷酸酶的调控亚基,它可以催化肌球蛋白轻链的去磷酸化,进而参与调控细胞运动,如平滑肌的收缩。MYPT1还可通过对RhoA磷酸化的抑制作用抑制胃癌细胞的增殖及转移活性 [30]。研究提示,肌球蛋白轻链MYL12A和MYL12B在恶性程度较高的乳腺浸润性导管癌中均呈强阳性表达,表明其与乳腺癌的发展密切相关。在具有高转移潜能的乳腺癌组织中,MYPT1表达受到抑制,导致MRLC磷酸化增加,从而加强肿瘤细胞的运动能力,促进转移 [4, 31-34]。
5.4 MYL12A和MYL12B与其它疾病的研究
肌球蛋白调节轻链(MYL12A和MYL12B)还与其它疾病有关:研究发现,在脑缺血再灌注后,缺血再灌注组+CCR5拮抗剂组(DAPTA)的大鼠梗死侧脑皮质中,ROCK2和P-MLC2(Ser19)蛋白表达较少,而缺血再灌注组(I/R)表现出更为明显的神经功能缺损和脑梗死灶。这说明CCR5可能通过ROCK途径影响MLC的磷酸化水平,进而影响脑缺血再灌注后的脑功能 [37];免疫球蛋白G包被颗粒的吞噬是通过Fcγ受体结合引起的,通过肌动蛋白依赖机制实现摄取 [38]。
进一步的研究发现,MYL9是通过Fcγ介导的吞噬过程中控制摄取的主要MRLC亚型,然而肌动蛋白轻链12A或12B在该过程中的缺乏 [38];TRE17癌蛋白能特异性直接结合MLC2蛋白,TRE17可以间接结合Rho蛋白家族的Cdc42和Racl,调节细胞骨架肌动蛋白重塑 [39];由平滑肌肌动蛋白轻链激酶(smooth muscle myosin light chain kinase,sm MLCK)介导的MYL12A/MYL12B的磷酸化引发了耳蜗毛细胞(HCs)中细胞形态变化,可能与听觉功能密切相关 [40]。
6. MYL12A和MYL12B的临床研究前景
肌球蛋白家族在疾病中的作用引起了广泛关注,其中肌球蛋白调节轻链RLCs(MYL12A和MYL12B)作为其重要组成部分,展现出广泛而有前景的临床研究潜力。研究表明,MYL12A和MYL12B参与了MLCK和Rho激酶等通路,涉及细胞增殖、转移、炎症等多个生物调控过程。此外,它们还被发现是CD69的配体,参与免疫反应。在肌球蛋白家族中,特别是肌球蛋白调节轻链(MRLCs)的磷酸化在不同肌肉组织中具有重要生物功能,展现了对多种疾病产生重要影响的潜力。随着研究的深入,MYL12A和MYL12B在心肌损伤、肿瘤、自身免疫性疾病等方面的作用逐渐明晰,这将为更多临床研究提供新的思路,可能成为未来研究的重要靶点!
为鼎力协助各药企针对MYL12A和MYL12B在听觉、心脏疾病、肠道屏障功能、缺血性脑病、癌症等疾病在临床中的研究,j9九游会登录入口首页CUSABIO推出MYL12A(CSB-EP015307HUc7)和MYL12B(CSB-EP015308HUc7)活性蛋白产品,助力您在MYL12A和MYL12B机制方面的研究或其潜在临床价值的探索。
j9九游会登录入口首页MYL12A和MYL12B蛋白
Code: CSB-EP015307HUc7

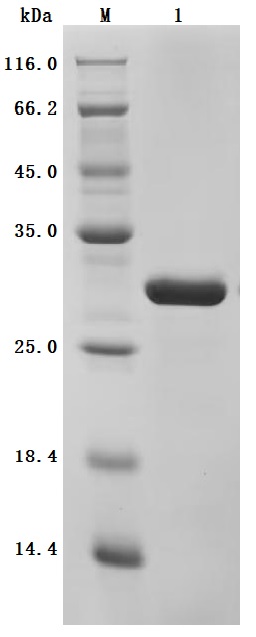
● High Purity: ≥ 95% as determined by SDS-PAGE.
● Verified Activity by a functional ELISA: immobilized Human MYL12A at 2μg/mL can bind Anti-MYL9 recombinant antibody (CSB-RA015318MA1HU). The EC50 is 5.325-6.456 ng/mL.
Code: CSB-EP015308HUc7
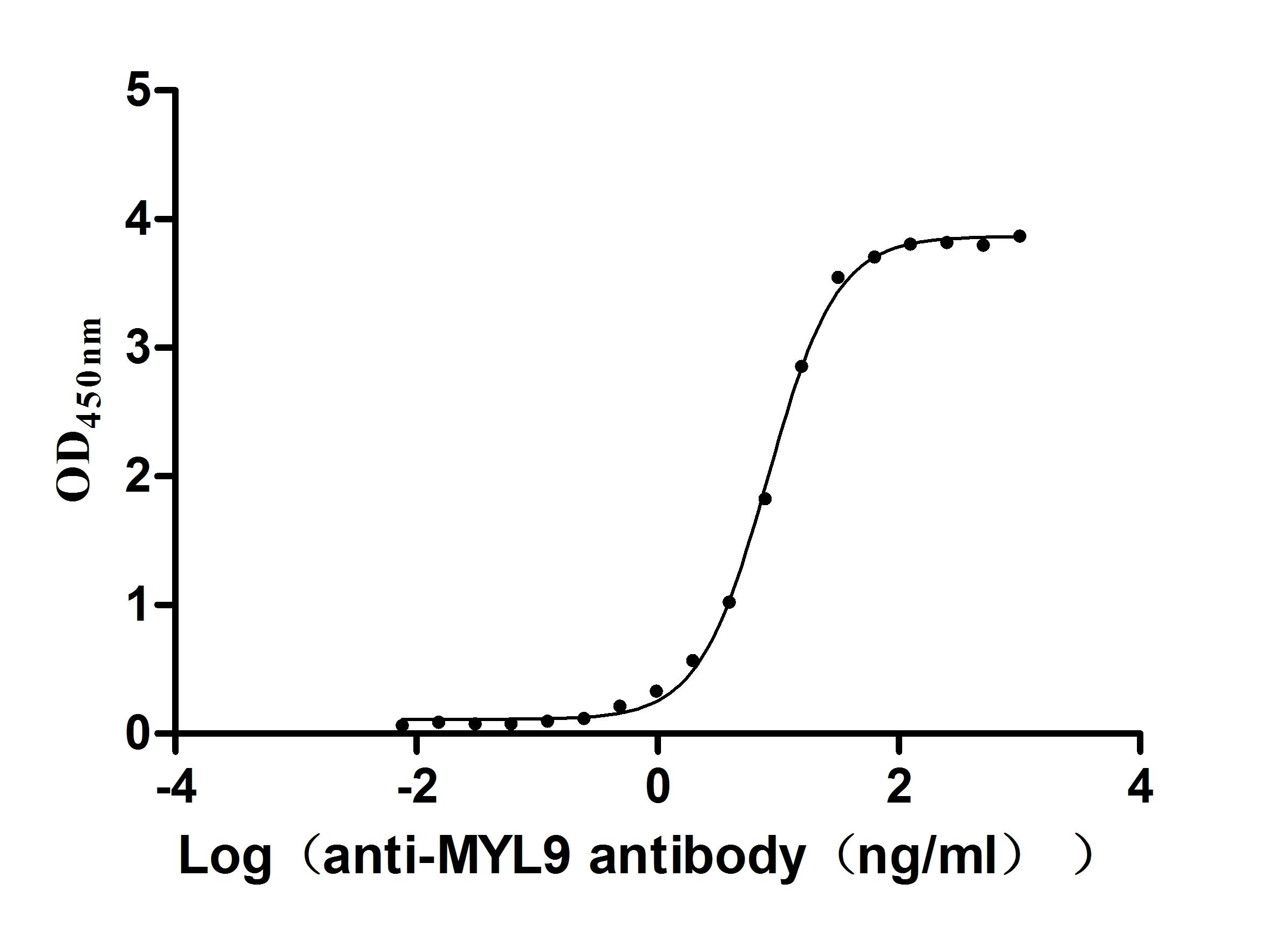
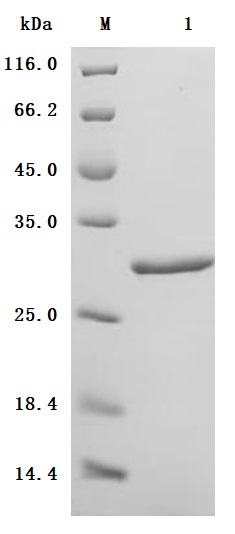
● High Purity: ≥ 95% as determined by SDS-PAGE.
● Verified Activity by a functional ELISA: Immobilized Human MYL12B at 2μg/mL can bind Anti-MYL9 recombinant antibody (CSB-RA015318MA1HU). The EC50 is 7.760-8.646 ng/mL.
参考文献:
[1] Cao, Lichuang, et al. "Phosphorylation of myosin regulatory light chain affects actomyosin dissociation and myosin degradation." International Journal of Food Science & Technology 54.6 (2019): 2246-2255.
[2] Gao, Xing, et al. "Dephosphorylation of myosin regulatory light chain modulates actin–myosin interaction adverse to meat tenderness." International Journal of Food Science & Technology 52.6 (2017): 1400-1407.
[3] Cao, Lichuang, et al. "Phosphorylation of myosin regulatory light chain at Ser17 regulates actomyosin dissociation." Food Chemistry 356 (2021): 129655.
[4] Aguilar-Cuenca, Rocío, et al. "Tyrosine phosphorylation of the myosin regulatory light chain controls non-muscle myosin II assembly and function in migrating cells." Current Biology 30.13 (2020): 2446-2458.
[5] Sweeney, H. Lee, and Erika LF Holzbaur. "Motor proteins." Cold Spring Harbor Perspectives in Biology 10.5 (2018): a021931.
[6] Mackay, Charles Edward. SrcFK is a key mediator of oxidant signalling pathways in Pulmonary Vascular Smooth Muscle. Diss. King's College London, 2016.
[7] Haraguchi, Takeshi, et al. "Discovery of ultrafast myosin, its amino acid sequence, and structural features." Proceedings of the National Academy of Sciences 119.8 (2022): e2120962119.
[8] Kumar, C. Chandra, et al. "Characterization and differential expression of human vascular smooth muscle myosin light chain 2 isoform in nonmuscle cells." Biochemistry 28.9 (1989): 4027-4035.
[9] Wang, Shaoxun, et al. "Down‐Regulation of Gamma‐Adducin Disrupts the Actin Cytoskeleton in FHH rats and May Contribute to the Development of Hypertension‐induced Renal Injury." The FASEB Journal 32 (2018): 721-10.
[10] Dabrowska, Magdalena, Marek Skoneczny, and Wojciech Rode. "Functional gene expression profile underlying methotrexate-induced senescence in human colon cancer cells." Tumor Biology 32 (2011): 965-976.
[11] Jiang, Yuhui, et al. "PKM2 phosphorylates MLC2 and regulates cytokinesis of tumour cells." Nature communications 5.1 (2014): 5566.
[12] Iwasaki, Takahiro, et al. "Diphosphorylated MRLC is required for organization of stress fibers in interphase cells and the contractile ring in dividing cells." Cell structure and function 26.6 (2001): 677-683.
[13] Gutjahr, Marc C., Jérémie Rossy, and Verena Niggli. "Role of Rho, Rac, and Rho-kinase in phosphorylation of myosin light chain, development of polarity, and spontaneous migration of Walker 256 carcinosarcoma cells." Experimental cell research 308.2 (2005): 422-438.
[14] Parker, Robert, et al. "Phosphoproteomic analysis of cell-based resistance to BRAF inhibitor therapy in melanoma." Frontiers in oncology 5 (2015): 95.
[15] Wang, Shibo, et al. "Myosin light chain kinase mediates intestinal barrier dysfunction following simulated microgravity based on proteomic strategy." Journal of proteomics 231 (2021): 104001.
[16] Hayashizaki, Koji, et al. "Myosin light chains 9 and 12 are functional ligands for CD69 that regulate airway inflammation." Science immunology 1.3 (2016): eaaf9154-eaaf9154.
[17] Kimura, Motoko Y., et al. "A new therapeutic target: the CD69-Myl9 system in immune responses." Seminars in immunopathology. Vol. 41. Springer Berlin Heidelberg, 2019.
[18] Yokoyama, Masaya, et al. "Myosin light chain 9/12 regulates the pathogenesis of inflammatory bowel disease." Frontiers in Immunology 11 (2021): 594297.
[19] Sun, Jie, et al. "Distinct roles of smooth muscle and non-muscle myosin light chain-mediated smooth muscle contraction." Frontiers in Physiology 11 (2020): 593966.
[20] Isobe, Kiyoshi, et al. "CRISPR-Cas9/phosphoproteomics identifies multiple noncanonical targets of myosin light chain kinase." American Journal of Physiology-Renal Physiology 318.3 (2020): F600-F616.
[21] Orgaz, Jose L., et al. "Myosin II reactivation and cytoskeletal remodeling as a hallmark and a vulnerability in melanoma therapy resistance." Cancer Cell 37.1 (2020): 85-103.
[22] Jin, Younggeon, and Anthony T. Blikslager. "The regulation of intestinal mucosal barrier by myosin light chain kinase/rho kinases." International Journal of Molecular Sciences 21.10 (2020): 3550.
[23] Kaibuchi, Kozo, Shinya Kuroda, and Mutsuki Amano. "Regulation of the cytoskeleton and cell adhesion by the Rho family GTPases in mammalian cells." Annual review of biochemistry 68.1 (1999): 459-486.
[24] Scruggs, Sarah B., and R. John Solaro. "The significance of regulatory light chain phosphorylation in cardiac physiology." Archives of biochemistry and biophysics 510.2 (2011): 129-134.
[25] Ito, Masaaki, et al. "Regulation of myosin light-chain phosphorylation and its roles in cardiovascular physiology and pathophysiology." Hypertension Research 45.1 (2022): 40-52.
[26] Ding, Peiguo, et al. "Cardiac myosin light chain kinase is necessary for myosin regulatory light chain phosphorylation and cardiac performance in vivo." Journal of Biological Chemistry 285.52 (2010): 40819-40829.
[27] Huang, Jian, et al. "Myosin regulatory light chain phosphorylation attenuates cardiac hypertrophy." Journal of Biological Chemistry 283.28 (2008): 19748-19756.
[28] Davis, Julien S., et al. "The overall pattern of cardiac contraction depends on a spatial gradient of myosin regulatory light chain phosphorylation." Cell 107.5 (2001): 631-641.
[29] Tohtong, R., et al. "Dependence of metastatic cancer cell invasion on MLCK-catalyzed phosphorylation of myosin regulatory light chain." Prostate cancer and prostatic diseases 6.3 (2003): 212-216.
[30] Wu, Qian, et al. "Deficiency in myosin light-chain phosphorylation causes cytokinesis failure and multipolarity in cancer cells." Oncogene 29.29 (2010): 4183-4193.
[31] https://www.proteinatlas.org/ENSG00000101608-MYL12A/pathology
[32] Xiao, Xiao, et al. "Transformer with convolution and graph-node co-embedding: an accurate and interpretable vision backbone for predicting gene expressions from local histopathological image." Medical Image Analysis 91 (2024): 103040.
[33] Li, Yin-Chao, et al. "Oridonin suppress cell migration via regulation of nonmuscle myosin IIA." Cytotechnology 68 (2016): 389-397.
[34] Hosono, Yasuyuki, et al. "MYBPH inhibits NM IIA assembly via direct interaction with NMHC IIA and reduces cell motility." Biochemical and Biophysical Research Communications 428.1 (2012): 173-178.
[35] Du, Liwen, et al. "Inhibition of the MLCK/MLC2 pathway protects against intestinal heat stroke-induced injury in rats." Journal of Thermal Biology 116 (2023): 103655.
[36] Rath, Nicola, and Michael F. Olson. "Regulation of pancreatic cancer aggressiveness by stromal stiffening." Nature medicine 22.5 (2016): 462-463.
[37] Li, Laisi, et al. "Effects of CC-chemokine receptor 5 on ROCK2 and P-MLC2 expression after focal cerebral ischaemia–reperfusion injury in rats." Brain Injury 30.4 (2016): 468-473.
[38] Bright, Michael D., and Gad Frankel. "PAK4 phosphorylates myosin regulatory light chain and contributes to Fcγ receptor-mediated phagocytosis." The International Journal of Biochemistry & Cell Biology 43.12 (2011): 1776-1781.
[39] Oliveira, Andre M., and Margaret M. Chou. "The TRE17/USP6 oncogene: a riddle wrapped in a mystery inside an enigma." Frontiers in Bioscience-Scholar 4.1 (2012): 321-334.
[40] Oya, Ryohei, et al. "Phosphorylation of MYL12 by Myosin Light Chain Kinase Regulates Cellular Shape Changes in Cochlear Hair Cells." Journal of the Association for Research in Otolaryngology 22 (2021): 425-441.
上一篇: DNA损伤与修复
下一篇: 重组蛋白的生产工艺流程











