细胞分化决定细胞的命运
日期:2023-12-05 16:01:00
细胞分化是细胞从一种类型转变为多种不同类型的过程。在细胞分化过程中,形态结构和生理功能出现差异。所有生物都起源于一个单细胞。例如,人类是从受精卵发展而来,这个过程涉及胚胎干细胞的分化。细胞分化在整个生命过程中都会发生。例如,造血干细胞分化为各种免疫细胞。
细胞异常分化可能导致癌细胞的产生。癌细胞无限分裂,形成肿瘤,危害人类健康。
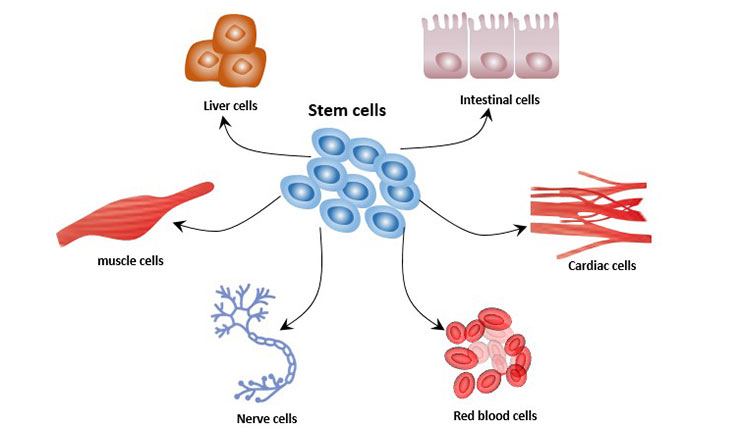
图1. 干细胞的细胞分化
细胞分化涉及多种信号转导过程:
1. MAPK信号通路
MAPK是一类线粒体中受体酪氨酸激酶的丝氨酸和酪氨酸双重磷酸化的蛋白激酶。MAPK信号通路通过级联反应(MAPKKK-MAPKK-MAPK)激活转录因子并调控基因表达。MAPK能够引起核内转录因子的激活,参与细胞表面到细胞核的信号传递过程,调控细胞增殖和分化。
目前,已知有4条MAPK信号通路,包括细胞外信号调节激酶(ERK)、c-Jun N末端激酶(JNK,也称为SAPK)、p38和ERK5通路。
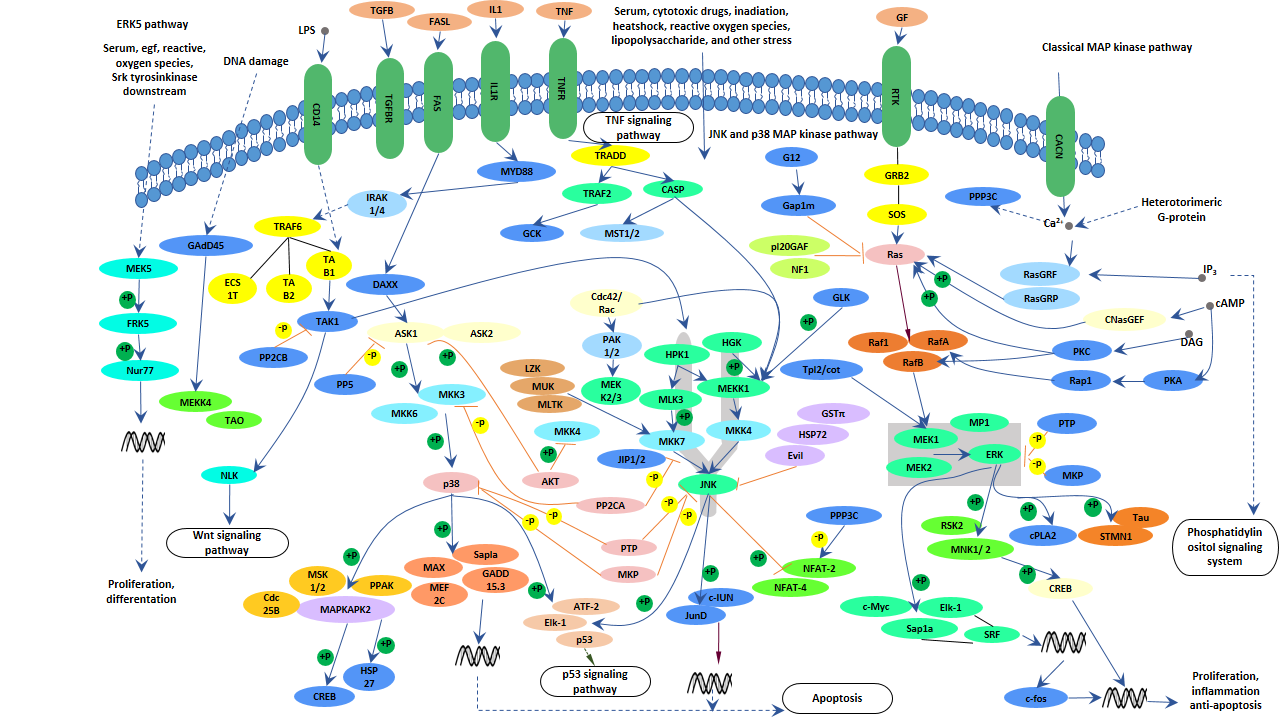
图2. MAPK信号通路
有关MAPK信号通路的更多信息,请参考以下链接:
/pathway/MAPK-signaling-pathway.html
1.1 ERK-MAPK信号通路
在MAPK信号通路中,ERK通路主要通过Ras-Raf-MEK-ERK级联反应起作用。
该通路的主要过程:生长因子通过与酪氨酸激酶受体结合来激活受体,激活的酪氨酸激酶受体激活Ras蛋白,然后Ras蛋白磷酸化Raf,激活的Raf磷酸化下游的MEK。MEK可以磷酸化和激活ERK,将其转移到细胞核,并通过激活其他激酶或转录因子来调控基因表达。
ERK-MAPK信号通路在间充质干细胞(MSCs)向脂肪细胞的分化中起作用 [1] [2]。在脂肪细胞分化的早期,ERK1/2通过促进C/EBPα和PPARγ的表达来促进脂肪细胞分化。在脂肪细胞分化的后期,活化的ERK1/2会磷酸化PPARγ以使其失活,并抑制脂肪细胞分化。
该通路还可以影响红细胞的增殖和分化。研究表明,ERK信号通路也参与成骨细胞分化和增殖的信号转导。
1.2 JNK-SAPK通路
c-Jun N末端激酶(JNK),也称为应激激活蛋白激酶(SAPK),是哺乳动物中的另一类MAPK亚类。JNK信号通路可以影响细胞生长、细胞分化和细胞死亡等多种生命过程。JNK可以改变骨钙素的mRNA水平,因此JNK的活化可以诱导成骨细胞分化。JNK信号通路在调节脂肪细胞分化中也起重要作用。
1.3 p38 MAPK通路
p38信号通路是MAPK家族的一个重要组成部分。p38 MAPK可以被多种细胞外应激响应激活,包括紫外线、辐射和促炎因子。
p38通路在间充质干细胞(MSCs)的成骨分化中起着非常重要的作用。抑制p38 MARK通路会下调蛋白激酶C(PKC)的活性,而PKC在细胞的成骨分化中发挥重要作用。此外,转化生长因子和骨形态发生蛋白BMP-2通过p38 MAPK通路诱导Runx2/Cbfa1转录表达。其中,Runx2是影响成骨活性的关键靶基因,而Cbfa1在转录水平上调节MSCs向成骨细胞的分化。
p38信号通路调节干细胞的分化方向,可能与p53蛋白稳定性的调节有关 [3] [4]。
p38激酶激活的细胞可以分化为来源于中胚层的组织细胞,如心肌细胞、骨骼肌细胞和平滑肌细胞;而p38激酶被抑制的细胞则发展为外胚层细胞,最终分化为神经细胞。
此外,ERK5/BMK1通路,这是一条非典型的MAPK通路,也参与了脂肪细胞分化和脂肪代谢的调节。
MAPK信号通路通过参与不同的途径和分子来调节细胞分化。
2. 磷脂酰肌醇信号通路(PLC)
在磷脂酰肌醇信号通路中,细胞外信号分子结合到G蛋白偶联受体上,激活贴壁脂酶C(PLC-β)位于细胞膜上,使磷脂酰肌醇(4, 5)二磷酸酯(PIP2)水解成肌醇1, 4, 5-三磷酸酯(IP3)和二酰基甘油(DG)。因此,磷脂酰肌醇信号通路(PLC)也被称为“双重信使系统”。
IP3打开钙通道并启动下游信号。Ca2+与钙调蛋白(CaM)结合形成Ca2+-CaM复合物,激活腺苷酸环化酶(AC)和磷酸二酯酶(PDEs);激活Ca2+-CaM依赖性蛋白激酶。
DG激活PKC,磷酸化蛋白的丝氨酸/苏氨酸残基,产生不同的细胞反应,如细胞分泌、肌肉收缩、细胞增殖和分化。PLC-γ通路还参与红细胞的分化。
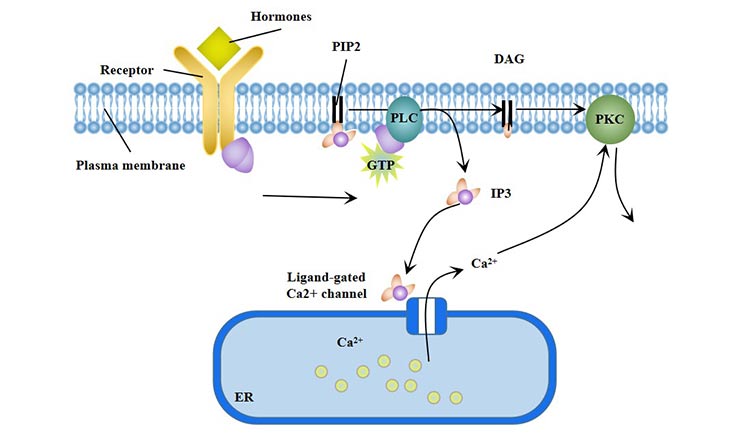
图3. 磷脂酰肌醇信号通路(PLC)
3. cAMP/PKA信号通路
环状腺苷酸单磷酸(cAMP)是一种重要的细胞内信号分子,它激活cAMP依赖性蛋白激酶A(PKA)并调节细胞的分化。cAMP/PKA信号通路可以促进间充质干细胞(MSCs)的脂肪分化 [5],并抑制其成骨分化。
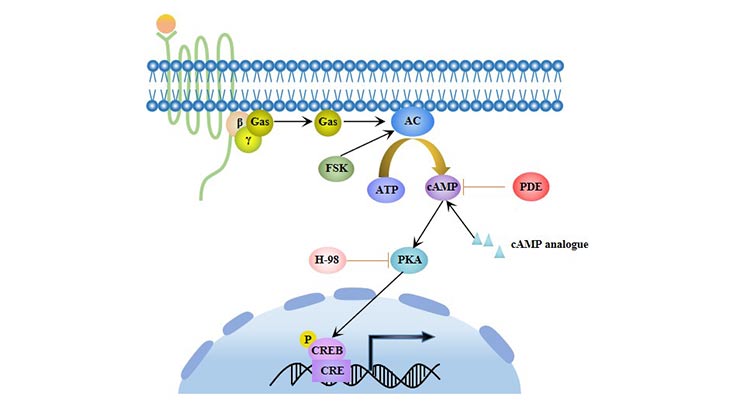
图4. cAMP/PKA信号通路
4. JAK-STAT信号通路
JAK是一种酪氨酸激酶,其主要底物是转录因子STAT。激活的STAT转位到细胞核并与DNA序列结合,从而调控基因表达。JAK-STAT信号通路在细胞增殖、凋亡和分化中起着重要作用。
该信号通路的主要过程如下:
配体与受体结合导致受体二聚化。二聚化的受体激活JAK,JAK磷酸化STAT。磷酸化的STAT形成二聚体,进入细胞核并与DNA序列结合,从而调控基因表达。
JAK/STAT信号通路在红细胞的增殖和分化中发挥重要作用 [6]。
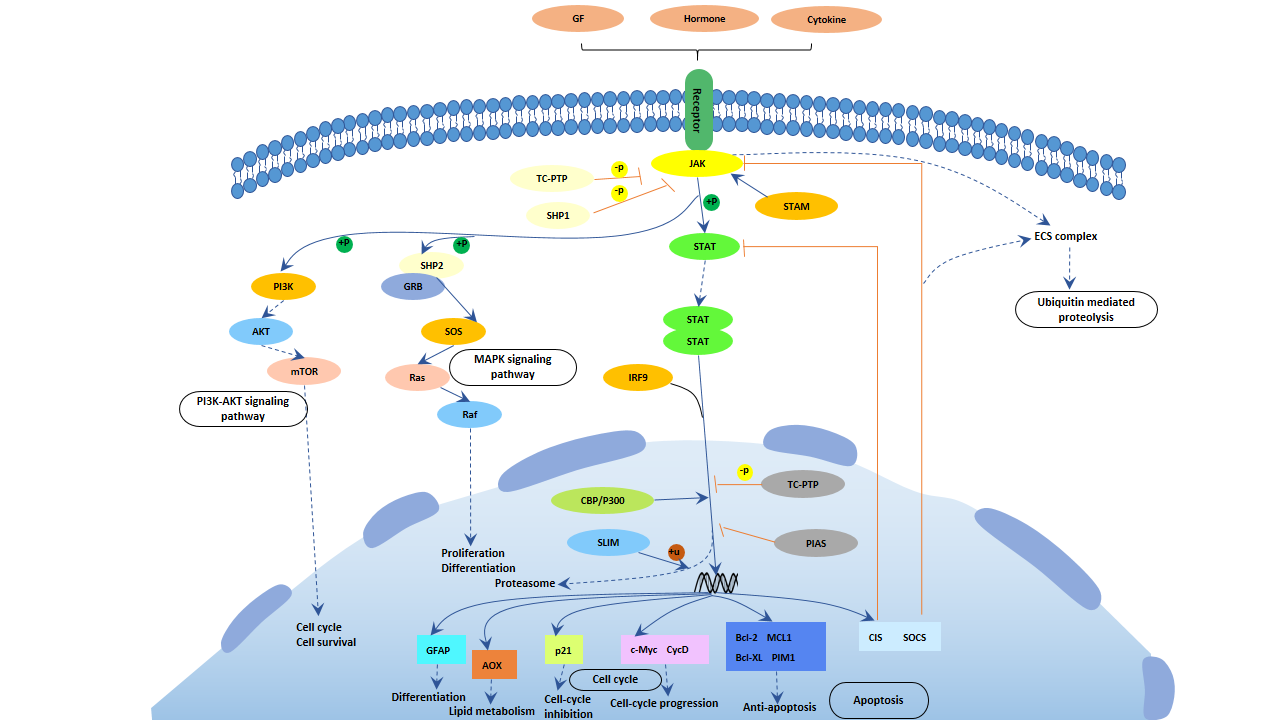
图5. JAK-STAT通路
5. PI3K-AKT-mTOR信号通路
哺乳动物雷帕霉素靶蛋白(mTOR)是一种保守的丝氨酸/苏氨酸蛋白激酶,有两种主要形式:mTORC1和mTORC2。激活的mTOR在细胞增殖、分化和代谢中起着关键调控作用。
mTOR主要由PI3K/Akt/mTOR信号通路和LKB1/AMPK/mTOR信号通路调节。这两个信号通路是调节睾丸支持细胞增殖和分化的主要途径。在mTOR信号通路中,mTOR基因的缺失导致睾丸支持细胞数量减少。
研究表明,被PI3K激活的Akt激酶在造血过程中发挥重要作用。PI3K信号通路在小肠干细胞再生和促进细胞分化中也很重要。

图6. PI3K-AKT-mTOR信号通路
6. Notch信号通路
在Notch信号通路中,配体结合到Notch受体,导致细胞内发生一系列信号转导反应,最终导致细胞分化或保持未分化状态。Notch配体包括Delta-like(Delta-like1, 3, 4)和Jagged(Jagged 1, 2)。
6.1 经典Notch信号通路
未激活的Notch受体在经过三次水解后释放出可溶性的细胞内域(NICD)。随后,NICD与DNA结合转录因子CSL和核转录激活因子家族MAML一起转移到细胞核,形成NICD-CSL-MAML三元转录激活复合物,最终激活下游靶基因的转录。
6.2 Notch信号通路与细胞分化
在干细胞中,Notch受体主要分布在干细胞表面。Notch通路调节干细胞的分化和增殖,在器官发育中起着重要作用。
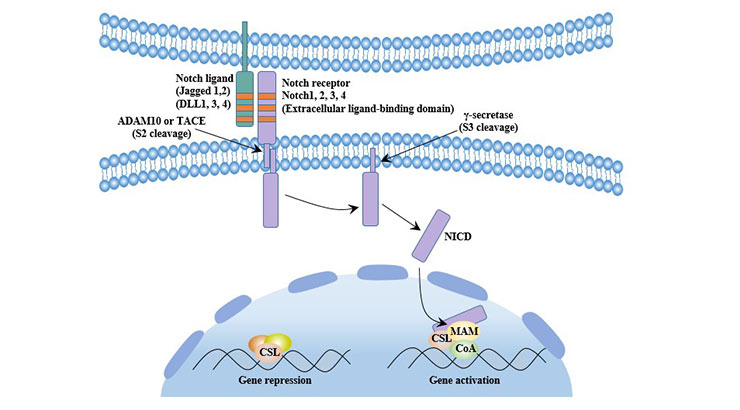
图7. 典型Notch信号通路
Notch信号通路调节着间充质干细胞(MSCs)的增殖和分化,促进MSCs向成骨细胞的分化。但是过度表达Notch可能会抑制骨骼形成。Notch通路还参与了肠道干细胞的分化。
研究证明,Notch信号和Wnt信号参与了干细胞分化为心脏肌细胞的过程,促进了早期心脏肌肉的分化,但抑制了晚期分化。不同时间信号通路的开启和关闭影响了干细胞在分化途径上的命运。因此,可以使用小分子化合物来调节特定的信号通路,从而触发定向分化或增强分化诱导效率。
Notch信号通路在免疫系统中也起着重要作用。干预Notch信号通路可以导致T细胞分化受阻。
6.3 Notch信号通路与CD4+ T细胞分化
Notch信号通路通过调节CD4+T细胞的分化和功能,调节了机体的免疫功能,对维持机体免疫平衡和各种疾病的发展起着重要作用。
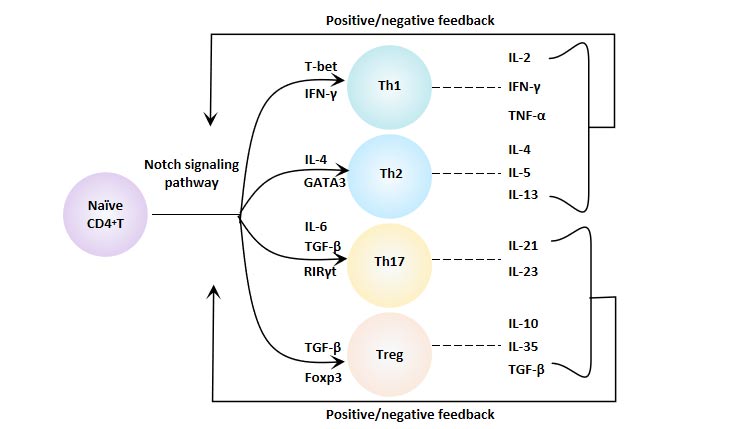
图8. Notch信号通路与CD4+ T细胞分化
6.3.1 Notch信号与Th1细胞
Notch分子通过与TBX21启动子结合,直接调控T-bet基因编码,从而调节Th1细胞的分化。Notch信号还通过与核因子κB(NF-κB)相互作用来促进Th1细胞的分化。此外,Notch1还可以通过Akt/ERK/GSK3β信号轴实现“串话”,从而增强T细胞分化为Th1的过程。有效阻断Notch通路可以有效限制Th1细胞的极化过程。
6.3.2 Notch信号与Th2细胞
T细胞中高表达的GATA-3与Th2细胞的极化密切相关。不成熟树突状细胞表达的Notch配体Jagged-1可以直接促进GATA3的转录,并诱导CD4+ T细胞向Th2细胞的极化。Jagged-2可以在体外驱动Th2细胞的分化,但在体内不影响Th2细胞的极化。Notch信号分子可以通过IL-4和GATA3分别促进Th2细胞的分化。
6.3.3 Notch信号与Th17细胞
RORγt是Th17细胞特异性转录因子。IL-17和RORγt是Notch信号的直接转录靶标。Jagged-1-Notch信号通路可以抑制与Th17产生相关的细胞因子的表达,如RORγt、IL-17A、IL-17F,从而抑制CD4+ T细胞向Th17细胞的分化。
总的来说,Notch信号通路在负调控Th17细胞的分化。然而,当机体有高代谢需求时,Notch可以通过影响细胞内细胞因子转运加速释放Th17细胞细胞因子,以抵消原来的效应。因此,认为Notch信号通路具有环境依赖性作用。
6.3.4 Notch信号与Treg细胞
调节性T细胞(Treg)的特征性转录因子是Foxp3。Notch信号通过转录水平调节Foxp3的表达,并通过干细胞(SCs)诱导调节Treg细胞的诱导。研究表明,Notch/RBP-J/FOXP3/RORγt通路调节了Th17/Treg的平衡。
6.4 Notch信号通路与NSCs分化
神经干细胞(NSCs)具有自我更新和多方向分化的能力,可以分化为神经元、星形胶质细胞和少突胶质细胞。其增殖和分化受到Notch信号通路的调控。
Notch信号通路的激活抑制NSCs分化为神经元,促进NSCs分化为星形胶质细胞,而阻断Notch信号通路则促进NSCs分化为神经元。
7. Wnt信号通路
Wnt信号通路高度保守,其核心组件是β-catenin。
当Wnt信号未被激活时,细胞内的β-catenin会被磷酸化并被蛋白酶体降解。
当Wnt蛋白与其受体Frizzled和LRP结合时,β-catenin降解复合物被非活化,β-catenin被释放并在细胞内积累。积累的β-catenin进入细胞核,与转录因子和T细胞因子/淋巴细胞增强因子(TCF/LEF)结合,启动与增殖相关的一系列基因。
7.1 Wnt信号通路与脂肪细胞分化
激活Wnt信号通路可以抑制脂肪细胞的分化 [17],而一旦该通路失控,就会发生肥胖 [18]。
Wnt信号通路通过白细胞介素-6(IL-6)和肿瘤坏死因子α(TNF-α)激活,从而抑制β-catenin的降解。β-catenin进一步抑制下游的C/EBP和PPAR,影响甚至阻止脂肪细胞的分化 [19]。
脂肪细胞的分化也受到PPARs信号通路和Hedgehog信号通路的影响。
PPAR家族在脂肪分化和代谢中发挥重要作用。其中,PPARγ作为脂肪分化的重要转录因子,可以加速脂肪细胞的分化和沉积 [20]。
Hedgehog(Hh)在细胞分化中也起着关键作用。
Hh信号通路在脂肪细胞分化过程中起着重要调节作用,但不足以触发脂肪细胞分化 [21]。
7.2 Wnt信号通路与软骨分化
激活Wnt信号通路可以促进软骨细胞分化。在软骨分化中,Wnt信号通路与许多其他通路共同促进间充质干细胞的软骨分化。
在软骨分化中,TGF-β和Wnt信号通路共同促进间充质干细胞的软骨分化。
此外,Wnt信号通路还可以促进小肠干细胞的分化和心肌细胞的分化,并促进睾丸支持细胞的增殖和分化。
8. TGF-β超家族信号通路
TGF-β超家族调节细胞的生长、增殖、分化、迁移和凋亡,调控胚胎发育,参与机体的免疫反应,具有多功能的生物活性[22]。TGF-β信号通路影响睾丸支持细胞的增殖和分化。
参考文献:
[1] BOST F, Caron L, MARCHETTI I, et al. Retinoic acid activation of the ERK pathway is required for embryonic stem cell commitment into the adipocyte lineage [J]. Biochemical Journal, 2002, 361(3): 621-627.
[2] Liao Q C, Li Y L, Qin Y F, et al. Inhibition of adipocyte differentiation by phytoestrogen genistein through a potential downregulation of extracellular signal-regulated kinases 1/2 activity [J]. Journal of cellular biochemistry, 2008, 104(5): 1853-1864.
[3] Aouadi M, BOST F, Caron L, et al. p38 Mitogen-Activated Protein Kinase Activity Commits Embryonic Stem Cells to Either Neurogenesis or Cardiomyogenesis [J]. Stem Cells (Miamisburg), 2006, 24(5): 1399-1406.
[4] Hadjal Y, Hadadeh O, Yazidi C, et al. A p38mapk-p53 cascade regulates mesodermal differentiation and neurogenesis of embryonic stem cells [J]. Cell Death and Disease, 2013, 4(7): e737.
[5] Li H, Fong C, Chen Y, et al. Beta-adrenergic signals regulate adipogenesis of mouse mesenchymal stem cells via cAMP/PKA pathway [J]. Molecular and Cellular Endocrinology, 2010, 323(2): 201-207.
[6] Dan X. Protein tyrosine phosphatases in the JAK/STAT pathway [J]. Frontiers in Bioscience, 2008, Volume(13): 4925-.
[7] Saha S, Ji L, De Pablo J J, et al. TGFβ/Activin/Nodal Pathway in Inhibition of Human Embryonic Stem Cell Differentiation by Mechanical Strain [J]. Biophysical Journal, 2008, 94(10): 4123-4133.
[8] Willems E, Lanier M, Forte E, et al. A Chemical Biology Approach to Myocardial Regeneration [J]. Journal of Cardiovascular Translational Research, 2011, 4(3): 340-350.
[9] Yashiroohtani Y, Ohtani T, Pear W S. Notch regulation of early thymocyte development [J]. Seminars in Immunology, 2010, 22(5): 261-269.
[10] Verma N K, Fazil M H U T, Ong S T, et al. LFA-1/ICAM-1 Ligation in Human T Cells Promotes Th1 Polarization through a GSK3? Signaling-Dependent Notch Pathway [J]. The Journal of Immunology, 2016.
[11] Roderick J E , Gonzalezperez G , Kuksin C A , et al. Therapeutic targeting of NOTCH signaling ameliorates immune-mediated bone marrow failure of aplastic anemia.[J]. Rare Diseases, 2013, 210(1):1311-29.
[12] Liotta F, Frosali F, Querci V, et al. Human immature myeloid dendritic cells trigger a TH2-polarizing program via Jagged-1/Notch interaction [J]. Journal of Allergy and Clinical Immunology, 2008, 121(4): 1000-1005.
[13] Krawczyk C M, Sun J, Pearce E J. Th2 Differentiation Is Unaffected by Jagged2 Expression on Dendritic Cells [J]. The Journal of Immunology, 2008, 180(12): 7931-7937.
[14] Coutaz M, Hurrell B P, Auderset F, et al. Notch regulates Th17 differentiation and controls trafficking of IL-17 and metabolic regulators within Th17 cells in a context-dependent manner [J]. Sci Rep, 2016, 6: 39117.
[15] Li H, Wang L, Pang Y, et al. In patients with chronic aplastic anemia, bone marrow–derived MSCs regulate the Treg/Th17 balance by influencing the Notch/RBP-J/FOXP3/RORγt pathway [J]. Scientific Reports, 2017, 7: 42488.
[16] Woo S M, Kim J, Han H W, et al. Notch signaling is required for maintaining stem-cell features of neuroprogenitor cells derived from human embryonic stem cells [J]. Bmc Neuroscience, 2009, 10(1): 97-0.
[17] Baron R, Kneissel M. WNT signaling in bone homeostasis and disease: from human mutations to treatments [J]. Nature Medicine, 2013, 19(2): 179-192.
[18] Gong M, Liu C, Zhang L, et al. Loss of the TNFα function inhibits Wnt/β-catenin signaling, exacerbates obesity development in adolescent spontaneous obese mice [J]. Molecular and Cellular Biochemistry, 2014, 391(1-2): 59-66.
[19] Gustafson B, Smith U. Cytokines Promote Wnt Signaling and Inflammation and Impair the Normal Differentiation and Lipid Accumulation in 3T3-L1 Preadipocytes [J]. Journal of Biological Chemistry, 2006, 281(14): 9507-9516.
[20] Frazier-Wood A C, Ordovas J M, Straka R J, et al. The PPAR alpha gene is associated with triglyceride, low-density cholesterol and inflammation marker response to fenofibrate intervention: the GOLDN study [J]. The Pharmacogenomics Journal, 2013, 13(4): 312-317.
[21] Fontaine C, Cousin W, Plaisant M, et al. Hedgehog Signaling Alters Adipocyte Maturation of Human Mesenchymal Stem Cells [J]. STEM CELLS, 2008, 26(4): 10.
[22] Akhurst R J, Hata A. Targeting the TGFβ signalling pathway in disease [J]. Nature Reviews Drug Discovery, 2012, 11(10): 790-811.
上一篇: 神经元标志物与神经退行性疾病
下一篇: 细胞活力概述











