Oct4——胚胎干细胞多能性的守门人
日期:2023-11-01 14:36:00
Oct4(八聚体结合转录因子)之名来自于其与八聚体基序DNA结合的能力。它还被称为Oct3、POU5F1、Oct-3/4、Otf3或NF-A3。它由POU5F1基因编码,属于POU转录因子家族的第5亚家族。Oct4是胚胎干细胞多能性的守门人,对于维持胚胎干细胞的多能性和自我更新起着极其重要的作用。Oct4还对诱导多能干细胞的产生至关重要。此外,Oct4在多种肿瘤中高度表达,这表明Oct4可能参与恶性肿瘤的发生和发展。
1. Oct4的组织特异性
Oct4在发育中的大脑中表达,高水平表达于皮层、嗅球、海马和小脑等特定细胞层。此外,Oct4主要在胚胎干细胞、胚胎生殖细胞和胚胎/生殖细胞肿瘤中表达。虽然成年组织中Oct4的表达水平较低,但在各种成年干细胞中广泛表达,主要包括:
● 来自乳腺、胰腺、胃、肝脏、肾脏和间充质组织的干细胞。
● 前体细胞,如外周血、乳腺上皮、子宫内膜和卵泡。
● 多能性前体细胞等。
体外,Oct4在未分化的胚胎干细胞(ES细胞)、胚胎癌细胞(EC细胞)和胚胎生殖细胞中具有高表达水平。随着这些细胞的分化,Oct4的表达水平下调 [1]。
在人类中,Oct4 mRNA在从未受精的卵母细胞到未压缩的囊胚阶段的胚胎发育的各个阶段均有表达 [2]。
2. 什么是Oct4?
2.什么是Oct4?
Oct4由Pou5fl基因编码,位于人类染色体6p21.3上。Oct4是POU转录因子家族的成员。它具有多个转录起始位点,可以转录成不同的mRNA亚型,从而翻译成多种蛋白质。
2.1 Oct4的亚型
人类Oct4基因可以通过选择性剪接产生三个亚型:Oct4A、Oct4B和Oct4B1 [3] [4]。Oct4可以翻译成四个蛋白亚型(Oct4A、oct4b-190、oct4b-265和oct4b-164)[5]。
2.1.1 Oct4A
Oct4A转录本包含外显子1、2b、2d、3和4。外显子1是Oct4A的特定部分。Oct4A由360个氨基酸组成,主要在未分化细胞的细胞核中表达。它是多能干细胞的特异性转录因子,与细胞的未分化特性相关。
2.1.2 Oct4B
Oct4B包含外显子2a、2b、2d、3和4。与Oct4A相比,Oct4B没有外显子1,但具有特定的外显子2a。
Oct4B由265个氨基酸组成,主要在各种非多能性细胞中表达,例如末分化的外周血单核细胞和膀胱肿瘤细胞。
Oct4B与Oct4A在POU结合区域和羧基端部分有相似的结构,但在氨基端的转录激活区域有所不同[6]。Oct4B的氨基端抑制了与DNA的结合,并抑制了Oct4激活因子的转录活性,从而失去了细胞多能性的调控功能。
2.1.3 Oct4B1
Oct4B1转录本与Oct4B非常相似,但包含额外的外显子2c。
OctB1主要在人类胚胎干细胞和胚胎癌细胞(ECC)中表达,其表达在细胞分化时迅速下调。
OctB1与Oct4B在POU结合区域和羧基端部分相同,其余氨基酸序列不同。Oct4B1增强了细胞的抗凋亡潜能,调节了细胞的多能状态。此外,Oct4B1也参与了肿瘤的进展。
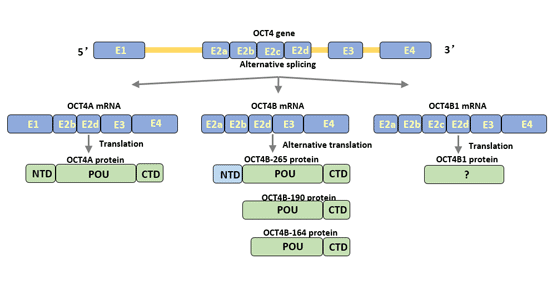
图1. Oct4亚型的结构
2.2 Oct4基因的结构
Oct4亚型1是主要的转录亚型之一,含有5个外显子和4个内含子。这个基因编码的蛋白质包含324个氨基酸,长度约为16.40 kb,相对分子质量为18 kD。
Oct4由三个结构域组成:N-转录域、POU结合域和C-转录域。
N-端区域:这个区域是一个转录激活区域,富含脯氨酸,具有与DNA结合和激活转录的功能,有助于稳定生物分子结构,降低细胞酸性和调节细胞氧化还原潜能。
POU结合域:一个保守的DNA结合域,结合含有八聚体序列的DNA,以调控下游靶基因的转录。
POU结合域包含两个亚基:N-端和C-端。N-端是POU家族(POUs)的独特保守结构域,富含脯氨酸和酸性残基。C-端是传统的异源域(POUh),富含脯氨酸、丝氨酸和苏氨酸残基。POUs和POUh之间由一个连接肽相连。
C-端区域:富含丝氨酸/苏氨酸,控制着不同细胞类型中Oct4A的转活性。
2.3 Oct4伪基因
目前已经发现了六个Oct4伪基因,分别是Oct4pg1、Oct4pg2、Oct4pg3、Oct4pg4、Oct4pg5和Oct4pg6。这些伪基因与Oct4 mRNA高度同源,但不具有Oct4的功能。Oct4伪基因的存在可能会在实验结果中引起假阳性,这给肿瘤和干细胞Oct4的研究带来了一些困扰。
3. Oct4基因的调控
Oct4的上游调控元件包括近端增强子(PE)和远端增强子(DE),在发育的不同阶段具有不同的功能。
例如,近端增强子作用于外胚层干细胞,而远端增强子则作用于内细胞团、原始生殖细胞和胚胎干细胞 [7]。许多因子通过作用于这两个调控元件来调控Oct4的表达。例如,孤儿核受体超家族因子可以结合到PE并影响Oct4的表达。
此外,一些物质,如Paf1复合物,可以直接与Oct4启动子相互作用,参与Oct4表达的激活。作为Oct4激活因子,它在维持胚胎干细胞Oct4的转录激活中起着重要作用。
Oct4也受到Sox2的调控。Sox2可以直接或间接调控Oct4的表达,从而影响胚胎干细胞的多能性。
Oct4蛋白的活性主要受到磷酸化或磺化的调控。
例如,通过蛋白激酶A和/或ERK MAPK在Oct4蛋白的POU结合域中高度保守的残基Ser 229(小鼠)或Ser 236(人类)的磷酸化可以在空间上阻碍DNA结合和同源二聚体的组装 [8]。
Oct4参与了几个信号通路的调节,包括转化生长因子(TGF)β通路、成纤维细胞生长因子(FGF)通路、磷脂酰肌醇-3-激酶(PI3K)通路、Wnt通路等。在心脏中胚层的特异分化过程中,TGF-β信号通路和经典Wnt信号通路共同诱导了Oct4的产生 [9]。
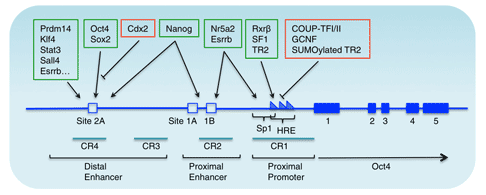
图2. 小鼠Oct4基因的基因组结构及转录调控 [10]
4. Oct4的功能
Oct4通过与启动子或增强子区域中的ATGCAAAT结合来调控靶基因的表达[11] [12]。这些靶基因主要包括YES1、FGF4、UTF1、ZFP206等与哺乳动物胚胎发育控制有关的基因。通过调控其下游靶基因,它参与了正常发育,尤其是在早期胚胎发育中。此外,Oct4的表达与干细胞的多能性有关。
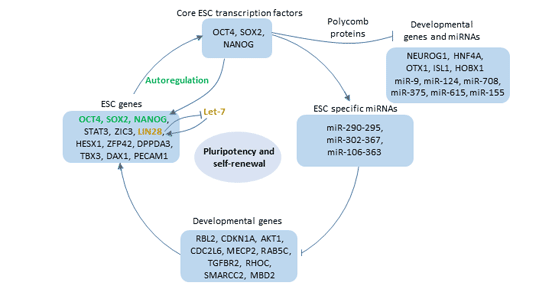
图3. Oct4的功能
4.1 Oct4与胚胎发育
胚胎干细胞(ESCs)是一类具有自我更新能力和多向分化潜能的细胞,可以分化为身体各种类型的组织细胞。Oct4是ESCs中的一个重要转录因子,在维持ESCs的多能性和自我更新能力方面发挥着关键作用。
Oct4通过激活多能性基因并抑制分化基因的表达,使ESCs保持自我更新和未分化状态。
Oct4在体内并不单独起作用。Oct4与Nanog和Sox2一起构成了多能性调控网络的核心,并被认为位于细胞全能性调控网络的顶端。这三个转录因子结合到自身基因的启动子上 [13],激活了自身基因的表达。
一方面,它们激活了与维持ES细胞自我更新有关的基因的转录。例如,Dppa4、Tdgf1、Oct4、Nanog和Lefty2都受到Oct4、Sox2和Nanog的正调控,并且在ES细胞中优先表达。
另一方面,Oct4、Sox2和Nanog共同占据与分化和发育有关的基因的启动子,并促使它们失活 [14]。
Oct4作为转录调节因子在转录过程中具有双重调节作用(转录抑制和转录激活),它不仅可以维持干细胞的未分化状态,还可以控制它们向特定细胞类型的分化。
在胚胎发育过程中,Oct4的水平决定了干细胞的分化或去分化,ES细胞的命运由Oct4的表达精确调控。当Oct4过度表达时,胚胎干细胞分化为原始内胚层和中胚层细胞。当Oct4的表达水平较低时,ES细胞失去多能性,分化为滋养层细胞。只有在适当的表达水平下,胚胎干细胞才能保持其自我更新状态。
研究发现,缺乏Oct4的胚胎只发育到囊胚阶段,内胚层的细胞不是多能性的,只能分化为滋养层细胞。而囊胚在植入时就死亡了 [15]。
在成体干细胞中,Oct4维持多能性的调节机制与ESC类似。
4.2 延缓细胞老化
Oct4延缓细胞老化的能力对于老化研究具有重大意义。Oct4在所有生物体的发育中都很重要,并在细胞的整个生命周期中保持活性。它保护血管中的动脉粥样硬化斑块,这是心脏病和中风的根本原因。
4.3 Oct4在重编程中的作用
细胞状态转变通常被认为是从较不分化的状态向较分化的状态转变,但研究表明,从体细胞向原始多能性的细胞状态转变也是可能的。这个过程是由于过表达Oct4、Sox2、Klf4和c-Myc等转录因子而诱导的。
其中,Oct4被认为是重编程中不可或缺的核心转录因子。Oct4调节细胞状态转变,如建立多能性和胚胎生殖细胞的分化。
通过将Oct4与Sox2、Klf4和c-Myc一起引入体细胞中,可以获得诱导多能干细胞(iPSCs)。iPSCs是从不同类型和类型的体细胞中获得的。
在上皮间质转变过程中,Oct4可以抑制TGF beta R3和TGF beta 3,同时激活miR-200 miRNA家族,从而分别抑制上皮间质转变(EMT)调节因子Snail和Zeb2,并最终促进间质向上皮转变(MET)。
Oct4、Sox2和Klf4引导重编程过程。Oct4A等外源性重编程因子可以直接或间接地沉默体细胞基因并激活多能性基因。内源性Oct4A和其他多能性基因可以维持诱导多能干细胞的多能状态。
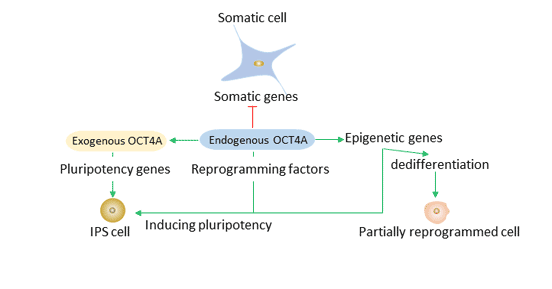
图4. Oct4在重编程中的作用
4.4 Oct4与肿瘤发生性
Oct4在胚胎生殖细胞瘤和成人细胞肿瘤中高度表达,这表明Oct4可能参与了恶性肿瘤的发生和发展。
Nanog和Oct4在乳腺癌组织中高度表达 [16]。Oct4的表达与前列腺癌的分化程度有关 [17]。在口腔鳞状细胞癌中,Nanog、Oct4和CD133的强表达与不良临床预后有关。Oct4的表达是维持某些肺癌细胞干细胞特性的关键 [18]。
多项研究表明,Nanog和Oct4在多种不受限制、分化差、侵袭性固体肿瘤中高表达,而它们的下调可能抑制肿瘤发展 [19]。
Oct4的过表达可能导致肿瘤发生、肿瘤转移以及化疗和放疗后的远处复发 [20] [21]。
因此,通过抑制Oct4的表达可以降低肿瘤细胞的自我更新能力。
研究表明,Oct4可能参与维持肿瘤干细胞的生存,沉默Oct4有望成为针对肿瘤干细胞的新方法。Oct4对肿瘤的生长、转移和复发有显著影响。研究表明,Oct4在人类乳腺癌细胞系7(MeF7)细胞中高度表达,通过RNAi技术沉默Oct4可以促进肿瘤干细胞的凋亡。
参考文献:
[1] Cauffman G, Van de Velde H, Liebaers I, et al. Oct-4 mRNA and protein expression during human preimplantation development [J]. Molecular human reproduction, 2004, 11(3): 173-181.
[2]Hansis C, Grifo J A, Krey L C. Oct-4 expression in inner cell mass and trophectoderm of human blastocysts [J]. Molecular human reproduction, 2000, 6(11): 999-1004.
[3]Takeda J, Seino S, Bell G I. Human Oct3 gene family: cDNA sequences, alternative splicing, gene organization, chromosomal location, and expression at low levels in adult tissues [J]. Nucleic acids research, 1992, 20(17): 4613-4620.
[4]Atlasi Y, Mowla S J, Ziaee S A M, et al. OCT4 spliced variants are differentially expressed in human pluripotent and nonpluripotent cells [J]. Stem cells, 2008, 26(12): 3068-3074.
[5]Wang X, Dai J. Concise review: isoforms of OCT4 contribute to the confusing diversity in stem cell biology [J]. Stem cells, 2010, 28(5): 885-893.
[6]Cauffman G, Liebaers I, Van Steirteghem A, et al. POU5F1 isoforms show different expression patterns in human embryonic stem cells and preimplantation embryos [J]. Stem cells, 2006, 24(12): 2685-2691.
[7]Shi G, Jin Y. Role of Oct4 in maintaining and regaining stem cell pluripotency [J]. Stem cell research & therapy, 2010, 1(5): 39.
[8]Brumbaugh J, Hou Z, Russell J D, et al. Phosphorylation regulates human OCT4 [J]. Proceedings of the National Academy of Sciences, 2012, 109(19): 7162-7168.
[9]Li Y, Yu W, Cooney A J, et al. Brief report: Oct4 and canonical Wnt signaling regulate the cardiac lineage factor Mesp1 through a Tcf/Lef-Oct4 composite element [J]. Stem cells, 2013, 31(6): 1213-1217.
[10] Wu G, Schöler H R. Role of Oct4 in the early embryo development [J]. Cell regeneration, 2014, 3(1): 7.
[11] Schöler, H.R, Balling R, Hatzopoulos A K, et al. Octamer binding proteins confer transcriptional activity in early mouse embryogenesis [J]. The EMBO Journal, 1989, 8(9):2551-2557.
[12]YOUNGILYEOM, Ha H, Balling R, et al. Structure, expression and chromosomal location of the Oct-4 gene [J]. Mechanisms of Development, 1991, 35(3): 171-179.
[13]Niwa H. How is pluripotency determined and maintained? [J]. Development, 2007, 134(4): 635-646.
[14]Christophersen N S, Helin K. Epigenetic control of embryonic stem cell fate [J]. Journal of Experimental Medicine, 2010, 207(11): 2287-2295.
[15]Chambers I, Tomlinson S R. The transcriptional foundation of pluripotency [J]. Development, 2009, 136(14): 2311-2322.
[16] Liu C, Lu Y, Wang B, et al. Clinical implications of stem cell gene Oct-4 expression in breast cancer [J]. Annals of surgery, 2011, 253(6): 1165-1171.
[17]Miyazawa K, Tanaka T, Nakai D, et al. Immunohistochemical expression of four different stem cell markers in prostate cancer: High expression of NANOG in conjunction with hypoxia‑inducible factor‑1α expression is involved in prostate epithelial malignancy [J]. Oncology letters, 2014, 8(3): 985-992.
[18]Chen Y C, Hsu H S, Chen Y W, et al. Oct-4 expression maintained cancer stem-like properties in lung cancer-derived CD133-positive cells [J]. PloS one, 2008, 3(7): e2637.
[19]Huang Z J, You J, Luo W Y, et al. Reduced tumorigenicity and drug resistance through the downregulation of octamer-binding protein 4 and Nanog transcriptional factor expression in human breast stem cells [J]. Molecular medicine reports, 2015, 11(3): 1647-1654.
[20]Koo B S, Lee S H, Kim J M, et al. Oct4 is a critical regulator of stemness in head and neck squamous carcinoma cells [J]. Oncogene, 2015, 34(18): 2317.
[21]Boumahdi S, Driessens G, Lapouge G, et al. SOX2 controls tumour initiation and cancer stem-cell functions in squamous-cell carcinoma [J]. Nature, 2014, 511(7508): 246.











