靶向药研发团宠:ADC药物的进阶之路
日期:2022-01-20 16:51:21

ADC技术的发展历程可大致分为4个阶段:
第一代属不成熟的早期尝试;
第二代属于采用化学偶联技术,产品是不同DAR值组分的混合物,加之偶联不稳定,安全窗窄,成药挑战较高;
第三代为定点定量偶联技术,采用低DAR值、高毒素的路线,均一性好,但实际临床表现仍在探索;
最先进的第四代ADC技术为高DAR值、中低毒素的技术路线,在稳定性、均一性方面均大幅提升。
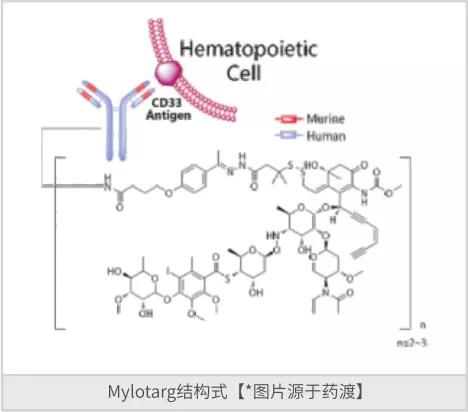
像所有新技术发展的路径一样,大多数的第一代的产品因为有很多缺陷成了炮灰。吉妥单抗(Gemtuzumab ozogamicin)是由比利时联合化工集团和辉瑞研发的是一种First-in-Class人源化单克隆抗体和抗体偶联药物(ADC)(图一),是一种CD33抑制剂和DNA抑制剂,其中抗体为重组人源化抗CD33单抗,细胞毒素为卡奇霉素。该药于2000年05月17日获美国FDA批准上市,商品名为Mylotarg,用于治疗急性髓细胞样白血病。但不幸的是,在批准后的多项研究中,Mylotarg与化疗相结合并未表现出比单独化疗更高的生存率和更高的致死毒性率,于2010年撤市。
第一代ADC药物失败的原因主要包括这两方面:
一方面是linker的化学性质不稳定,在未达到靶点时就易被水解,以至于不能实现定点偶联,导致药效有限;
另一方面是血液中药物浓度低于治疗有效浓度,而靶点抗原低表达又导致药物递送量少,细胞内药物不足以杀死细胞。
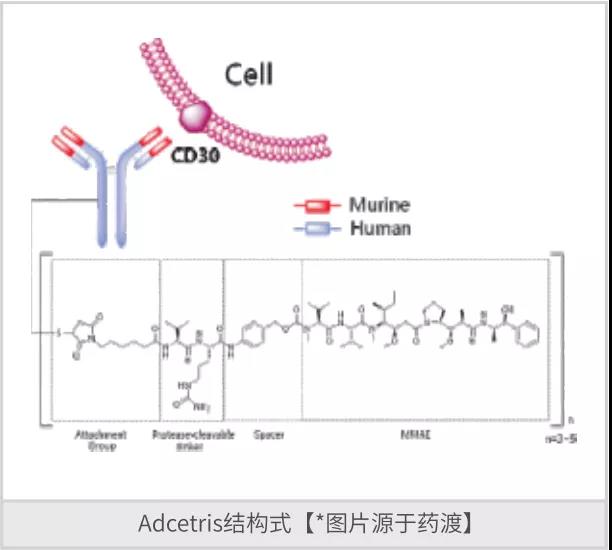
维布妥昔单抗(Brentuximab vedotin)是由Millennium Pharmaceuticals Inc和Seattle Genetics Inc研发的是一种First-in-Class嵌合单克隆抗体和抗体偶联药物(ADC),是一种CD30调节剂和微管蛋白聚合抑制剂。该药于2011年8月获得FDA批准上市,商品名为Adcetris,用于治疗蕈样真菌病,原发性皮肤间变性大细胞淋巴瘤,霍奇金病,间变大细胞淋巴瘤和皮肤T细胞淋巴瘤。其中单抗选择性靶向CD30,细胞毒素MMAE作用于微管蛋白。
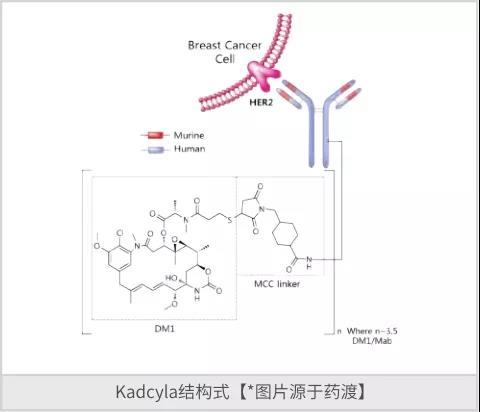
恩美曲妥珠单抗(Ado-trastuzumab emtansine)是由基因泰克研发的是一种First-in-Class抗体偶联药物(ADC)和人源化单克隆抗体,是一种抗HER2,微管蛋白抑制剂和微管蛋白聚合抑制剂。该药于2013年2月获得FDA批准上市,商品名为Kadcyla,用于治疗之前接受过曲妥珠单抗和紫杉类化疗失败的HER2阳性乳腺癌患者。Kadcyla,是一个靶向HER2 抗体药物偶联物 (ADC),含人源化抗HER2 IgG1曲妥珠单抗(Trastuzumab)和微管抑制剂DM1(美登素衍生物),两者通过稳定硫醚连接物(MCC)共价连接。
第二代ADC药物的研发中,mAb技术得到改进,单克隆抗体被仔细选择,提高了肿瘤细胞靶向性,并减少与健康细胞交叉反应。与第一代ADC相比,第二代ADC具有更好的CMC特性。从2011-2017间FDA批准的三种二代ADC药物来看(Adcetris、Kadcyla、ozogamicin),第二代ADC药物显示出良好的临床疗效和安全性。但是它们并不是没有缺点。它们的问题主要存在于抗体的载药率(Drug-to-Antibody Ratio/ DAR),第二代ADC药物的DAR为8,但是一般DAR为3-4比较合适,DAR > 4会出现较低的耐受性与内疗效、较高的血浆清除率;由于细胞毒素并没有非常特异的靶点,所以存在严重的肝毒性等不良反应,导致治疗窗口很窄;同时,ADCs药物的细胞穿透能力有限,这也影响了它们的治疗效果与毒副作用。
自2018年Lumoxiti(阿斯利康)获批后,第三代ADC药物(以Polivy为代表)密集获批,ADC药物迈入了爆发期。仅2019年一年就有Polivy、Padcev、Enhertu三个ADC药物获批上市。随后至今,Trodelvy、Blenrep和Zynlonta相继密集获批。
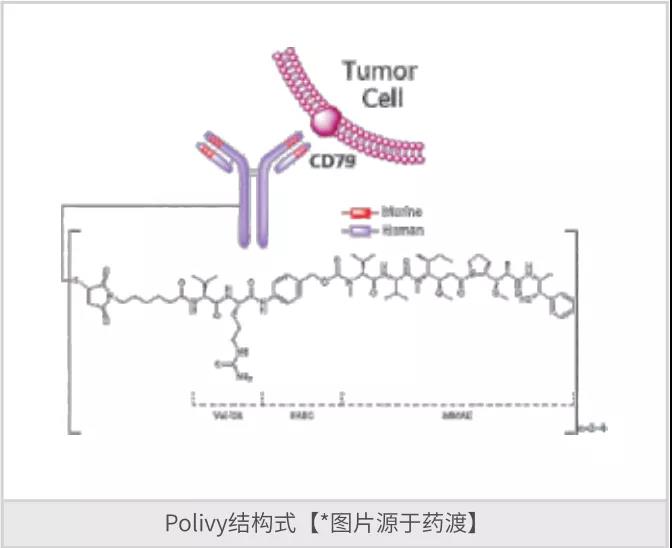
维博妥珠(Polatuzumab vedotin)是由基因泰克和Seattle Genetics研发的是一种First-in-Class抗体偶联药物(ADC)和人源化单克隆抗体,是一种抗CD79B和微管蛋白聚合抑制剂。该药于2019年6月获得FDA批准上市,商品名为Polivy,用于治疗弥漫性大B-细胞淋巴瘤和B-细胞淋巴瘤。
Polivy由三个部分组成:抗体(Antibody,抗CD79b的抗体);连接物(Linker,可裂解的蛋白酶连接肽);细胞毒素(MMAE,一甲基澳瑞他汀E)。
第三代ADC药物综合了一代二代失败的因素,利用小分子药物与单克隆抗体的位点特异性结合,产生DARs为2或4的ADC,这种ADC药物毒性降低,无未结合的单克隆抗体,稳定性和药代动力学大大提高,偶联脱落速度更低,药物活性高,低抗原水平下的细胞活性高。
正如开篇所提及到的,第四代ADC技术为高DAR值、中低毒素的技术路线,在稳定性、均一性方面均大幅提升。其特点之一是启用了喜树碱类拓扑异构酶I抑制剂作为低毒性的毒素。
第四代ADC药物以戈沙妥组单抗(Sacituzumab govitecan)为代表,戈沙妥组单抗是由Immunomedics Inc研发的是一种First-in-Class抗体偶联药物(ADC)和人源化单克隆抗体,是一种TOP1抑制剂和抗Trop-2。该药于2020年4月获得FDA批准上市,商品名为Trodelvy,用于治疗三阴性乳腺肿瘤和移行细胞癌。Trodelvy由靶向TROP-2抗原的人源化IgG1抗体与化疗药物伊立替康(一种拓扑异构酶I抑制剂)的代谢活性产物SN-38偶联而成。
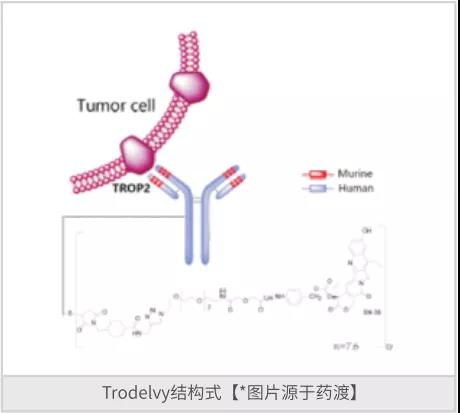
值得一提的是,Trodelvy作为一款靶向Trop-2的新型、首创的抗体偶联药物(ADC),曾被FDA授予加速批准权,优先审评权,突破性疗法资格认定和FDA药物评审快速通道。FDA完全批准Trodelvy是基于一项全球多中心III期临床试验——ASCENT,在该项试验中,Trodelvy将疾病进展和死亡风险降低57%,中位无进展生存期由化疗的1.7个月提升至4.8个月;死亡风险降低49%,总生存期由6.9个月提升至11.8个月。
在过去的十年中,ADCs已经通过选择更好的细胞毒性药物、生物偶联方法、更好的靶向抗原和优化的抗体工程得到了改进。然而,它仍存在一些局限性(如有限的实体瘤渗透性和毒性)以及耐药机制的出现。为了克服这些局限性,人们研究了新的抗体形式、新的传递系统、非内化抗原靶点、新的细胞毒性药物和位点特异性生物偶联方法来促进ADC的发展。虽然许多创新尚未在临床方案中得到验证,但这一领域的研究为我们提供了许多令人鼓舞的结果。相信ADC未来的十年将会迎来更加辉煌的前景。
—END—
——j9九游会登录入口首页生物·让科研变得有温度!——