Claudin 18.2,抗肿瘤治疗的“黑马”靶点
日期:2021-05-28 09:58:41
2020年5月,全球首个针对Claudin 18.2的CAR-T疗法在美国获批;2020年6月,全球首个Claudin 18.2/PD-L1双特异性抗体的临床前数据在AACR上公布;2020年7月1日,安进和百事公司的CD3/Claudin 18.2双抗体临床申请在中国获批。同一天,创生公司宣布Claudin 18.2单克隆抗体在美国临床试验中完成了第一个病人的用药。这一系列的进展使Claudin 18.2靶点再次成为人们关注的焦点。
最近,由Sahin U公司主导的一项名为“a randomised phase II study of zolbetuximab (IMAB362) plus EOX versus EOX alone for first-line treatment of advanced CLAUDIN18.2-positive gastric and gastro-oesophageal adenocarcinoma”的FAST研究。研究结果显示Zolbetuximab联合化疗对Claudin18.2高表达的G/GEJ/EC有生存获益。同时,这项研究进一步证实了靶向Claudin18.2的药物在胃癌治疗中具有极大潜力[1]。那么,Claudin18.2究竟是何方神圣?它又是如何让各大企业争相追捧的呢?本文从以下几个方面简单介绍了Claudin18.2。
1、Claudin18.2的定义
在介绍Claudin18.2之前,我们先来了解下什么是Claudin。Claudin是一类存在于上皮和内皮紧密连接(tight junction)中的整合素膜蛋白,最早由Shoichiro Tsukita等于1998年发现。紧密连接,又称闭锁小带,是相邻细胞膜共同构成的一个事实上液体无法穿透的屏障,多位于极化上皮细胞和内皮细胞最顶端[2],是两个细胞间紧密相连的区域。而Claudins是紧密连接的重要组成部分。几乎所有的脊椎动物都有Claudin蛋白。大多数物种只种Claudin,但人类有除了Claudin 13之外,从Claudin 1到Claudin 27的26种Claudin。
Claudin-18 (CLDN18)是Claudin(CLDN)蛋白家族中的重要成员,肺和胃上皮细胞紧密连接的一个主要成分。CLDN18有两个异构体:Claudin18.1和Claudin18.2。Claudin18.1主要在肺部表达,Claudin18.2主要在胃上皮细胞中表达,而且,Claudin 18.2只在胃粘膜上分化的上皮细胞中表达,正常情况下是不表达于其他任何健康组织。然而,它在原发性恶性肿瘤中高度表达,如胃癌、乳腺癌、结肠癌和肝癌。
2、Claudin18.2的结构
人的CLDN18基因位于3q22号染色体,长度约35kb,由6个外显子和5个内含子组成(图1)。它有两个不同的外显子1(外显子1a和1b),这两个外显子经过转录和不同的剪接,产生两种异构体,即Claudin18.1和Claudin18.2,这两个构体仅在N端有不同的序列。
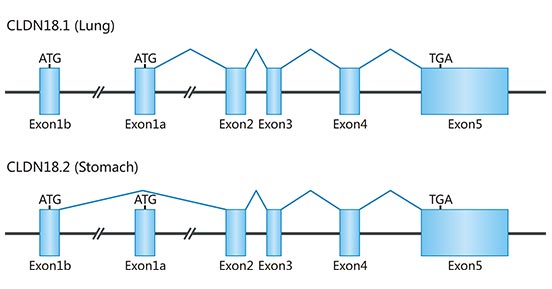
图1. Gene structure of CLDN18
*图片参考文献3。
Claudin18.1和Claudin18.2都由261个氨基酸组成,有四个跨膜结构域(Figure 2)和两个胞外环(胞外环:ECL1,ECL2),其NH2和COOH端均位于细胞内。Claudin18.1和Claudin18.2 仅在ECL1大约50个氨基酸的序列中有7个氨基酸残基差异[5]。
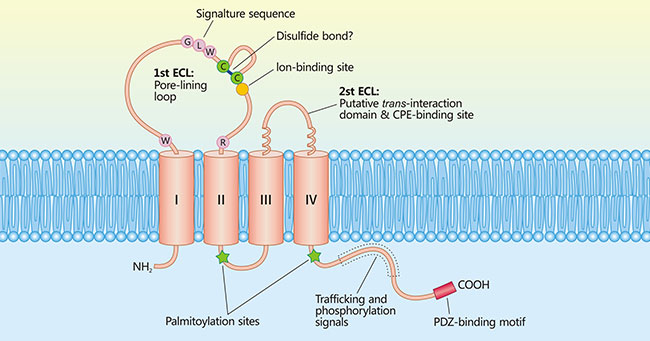
图2. claudin-protein-2.jpg
*图片参考文献4。
在第一部分中已说到,Claudin18.2的表达具有组织特异性,它在且只在胃粘膜上已分化的细胞中表达,这表明它在胃上皮层完整性的特殊要求中起重要作用[6][7]。此外,Claudin18.2的表达在恶性转化时不会消失,所以在很大一部分胃癌中能检测到。
3、Claudin18.2在癌症中的作用
Claudin的异常表达可导致上皮细胞和内皮细胞的结构损伤和功能受损。它在各种上皮源性肿瘤中的异常表达表明,Claudin可能在肿瘤的侵袭和转移中发挥重要作用。不同的Claudin表达在不同的组织上,其功能的改变与各自组织的癌症形成息息相关[8]。比如,Claudin-1的表达已被证明对结肠癌有预后价值[9],Claudin-18对胃癌有预后价值[10],Claudin-10对肝细胞癌有预后价值[11][12]。
目前,Claudin 18.2是研究得最为清楚的Claudin家族蛋白。在正常组织中,Claudin的表达具有高度组织特异性,仅在埋藏于胃粘膜上已分化的上皮细胞中表达,而且正常组织中的单克隆抗体基本上检测不到。但是,恶性肿瘤的发生会导致紧密连接的破坏,使肿瘤细胞表面的Claudin18.2表位暴露出来,成为特定的靶点。因此,理论上,在胃癌(40%-80%)领域,针对Claudin18.2的治疗性抗体具有更大的抗癌潜力和更低的毒性。目前在胃癌细胞系中,Claudin18.2已被证明参与了肿瘤细胞的增殖和趋化。此外,在胰腺癌(50%)、食道癌(30%)和非小细胞肺癌(25%)中也经常观察到异常激活的Claudin18.2[13] [14]。
相关研究表明,Claudin18.2在癌症和正常组织中的显著变化可能是由于Claudin18.2启动子区域的CREB结合位点在正常组织中高度CpG甲基化,而在正常细胞中,CpG甲基化水平在致癌过程中降低,因此CREB参与激活Claudin18.2的转录[6]。
4、靶向Claudin 18.2的疗法有哪些?
Claudin18.2作为细胞膜表面蛋白,其暴露的细胞外结构允许抗体结合,这些特征表明Claudin18.2是开发治疗性单克隆抗体的理想靶点。但由于Claudin18.1与Claudin18.2在细胞外结构域ECL1上仅有7个氨基酸残基的差异,设计一种特异性识别Claudin18.2而不识别Claudin18.1的抗体已成为该靶点单克隆抗体开发的一个挑战。因此,目前许多制药公司都在关注Claudin18.2,但由于难以获得高质量的Claudin18.2抗原,能够在该靶点上获得突破的很少。
目前,全球针对CLAUDIN18.2的产品类型包括单克隆抗体、双特异性抗体、CAR-T和ADC。其中,开发中的单克隆抗体数量最多。在此,我们在下表中列出了CLAUDIN 18.2靶向药物开发的最新进展情况。
| 药物名称 | 研发状态 | 公司 | 适应症 | 药物类型 | 最后更新日期 |
|---|---|---|---|---|---|
| Zolbetuximab | 临床三期 | 安斯泰来制药(中国)有限公司 | 食道癌、胃癌、腺癌、胰腺癌、胃肠疾病、囊性淋巴管瘤、疼痛和实体瘤 | 嵌合单克隆抗体 | 2020-08-28 |
| LCAR-C18S CAR-T cell therapy | 临床一期 | 上海东方医院 | 胃癌 | CAR-T | 2020-11-06 |
| Q-1802 | 临床一期 | 启愈生物技术(上海)有限公司 | 实体瘤 | 双特异性抗体 | 2021-04-16 |
| LM-102 | 临床一期 | 礼新医药科技(上海)有限公司 | 实体瘤 | 生物药 | 2021-04-25 |
| TJ-CD4B | 临床一期 | 天境生物科技(上海)有限公司 | 肿瘤 | 双特异性抗体 | 2021-04-01 |
| Recombinant humanized anti-Claudin 18.2 monoclonal antibody | 临床一期 | 科济生物医药(上海)有限公司; | 实体瘤、胃癌和胰腺癌 | 人源化单克隆抗体 | 2020-08-28 |
| KD-022 (Nanjing KAEDI Biotech) | 临床一期 | 南京凯地生物科技有限公司 | 肿瘤 | CAR-T | 2020-11-06 |
| Claudin18.2 (CLDN18.2) humanized monoclonal antibody (Mabspacebio) (Claudin18.2) | 临床一期 | Mabspace Biosciences Co Ltd | 胃癌、实体瘤、肿瘤、胆管癌、胆囊癌、肺癌和食道癌 | 人源化单克隆抗体 | 2021-04-19 |
| HBM-1029 | 临床前 | 和铂医药 | 实体瘤 | 单克隆抗体 | 2020-09-11 |
| HLX-58 | 临床前 | 上海复宏汉霖生物医药有限公司 | 实体瘤 | 未知 | 2021-01-04 |
| BNT-212 | 临床前 | Biontech Se | 实体瘤和胰腺癌 | CAR-T | 2021-03-16 |
| SOT-102 | 临床前 | Sotio | 实体瘤 | 抗体偶联药物(ADC) | 2021-04-13 |
5、Claudin 18.2相关试剂
Claudin-18.2 Monoclonal Antibody (CSB-RA005498A1HU) (ELISA, FC)
参考文献:
[1] Sahin U, TürECi Ö, Manikhas G, et al. FAST: a randomised phase II study of zolbetuximab (IMAB362) plus EOX versus EOX alone for first-line treatment of advanced CLAUDIN18.2-positive gastric and gastro-oesophageal adenocarcinoma [J]. Ann Oncol, 2021. 32(5): 609-619.
[2] Schneeberger EE, Lynch RD. The tight junction: a multifunctional complex [J]. Am J Physiol Cell Physiol. 2004, 286: C1213-28.
[3] Özlem Türeci; Michael Koslowski; Gerd Helftenbein, et al. Claudin-18 gene structure, regulation, and expression is evolutionary conserved in mammals [J]. Gene. 2011, 481(2), 83–92.
[4] Gunzel, D.; Yu, A. S. L. Claudins and the Modulation of Tight Junction Permeability [J]. Physiological Reviews. 2013, 93(2), 525–569.
[5] Klamp, T. et al. Highly specific auto-antibodies against claudin-18 isoform 2 induced by a chimeric HBcAg virus-like particle vaccine kill tumor cells and inhibit the growth of lung metastases [J]. Cancer Res. 2011, 71, 516-527.
[6] Sahin U, Koslowski M, Dhaene K, et al. Claudin-18 splice variant 2 is a pan-cancer target suitable for therapeutic antibody development [J]. Clin Cancer Res. 2008, 14: 7624–34.
[7] Patrick Micke, Johanna Sofia Margareta Mattsson, Karolina Edlund, et al. Aberrantly activated claudin 6 and 18.2 as potential therapy targets in non-small-cell lung cancer [J]. Int. J. Cancer. 2014, 135, 2206–2214.
[8] Morin PJ. Claudin proteins in human cancer: promising new targets for diagnosis and therapy [J]. Cancer Res. 2005, 65(21): 9603–6.
[9] Resnick MB, Konkin T, Routhier J, et al. Claudin-1 is a strong prognostic indicator in stage II colonic cancer: a tissue microarray study [J]. Mod Pathol. 2005, 18(4): 511–8.
[10] Sanada Y, Oue N, Mitani Y, et al. Downregulation of the claudin-18 gene, identified through serial analysis of gene expression data analysis, in gastric cancer with an intestinal phenotype [J]. J Pathol. 2006, 208(5): 633–42.
[11] Cheung ST, Leung KL, Ip YC, et al. Claudin-10 expression level is associated with recurrence of primary hepatocellular carcinoma [J]. Clin Cancer Res. 2005, 11(2 Pt 1): 551–6.
[12] Prabhsimranjot Singh, Sudhamshi Toom and Yiwu Huang. Anti-CLAUDIN 18.2 antibody as new targeted therapy for advanced gastric cancer [J]. Journal of Hematology & Oncology. 2017, 10:105.
[13] Risa Akizuki, Shun Shimobaba, Toshiyuki Matsunaga, et al. Claudin-5, -7, and -18 suppress proliferation mediated by inhibition of phosphorylation of Akt in human lung squamous cell carcinoma [J]. Biochimica et Biophysica Acta. 2017, 1864: 293–302.
[14] Zhu, G., et al. Correction: Targeting CLAUDIN18.2 by CD3 Bispecific and ADC Modalities for the Treatments of Gastric and Pancreatic Cancer [J]. Sci Rep. 2019, 9(1): 16735.











