文献解读│Cell重磅癌症免疫疗法新靶点——IL4I1
日期:2020-09-25 11:44:00

研究背景及目的
AHR也被称为二恶英受体,能介导二恶英的毒性作用。人体自身的代谢产物也能激活这一受体,由吲哚胺-2,3双加氧酶1/2(IDO1/2)或色氨酸-2,3-双氧合酶(TDO2)驱动的犬尿氨酸(Kyn)途径被认为是人体内主要的色氨酸(Trp)分解代谢途径,产生AHR激动剂Kyn和犬尿喹啉酸(KynA)。IDO1抑制剂联合抗PD1单抗的免疫疗法III期临床试验失败,说明体内还存在其它的Trp代谢酶(IDO1和TDO2除外)激活AHR。研究人员开发了一种AHR泛组织信号,用于全面了解各种肿瘤类型中AHR的活性及其上游的调控分子。
结论
Trp代谢酶IL4I1生成的吲哚代谢物和KynA能激活AHR。IL4I1与胶质瘤患者存活率降低相关、促进肿瘤细胞迁移、抑制获得性免疫应答、促进小鼠模型中慢性淋巴细胞白血病(CLL)恶化。免疫检查点阻断(ICB)诱导IDO1和IL4I1的表达。IL4I1可能是IDO1抑制剂联合ICB临床试验失败的原因。因而,IL4I1阻断剂为癌症治疗开辟了新途径。
结果
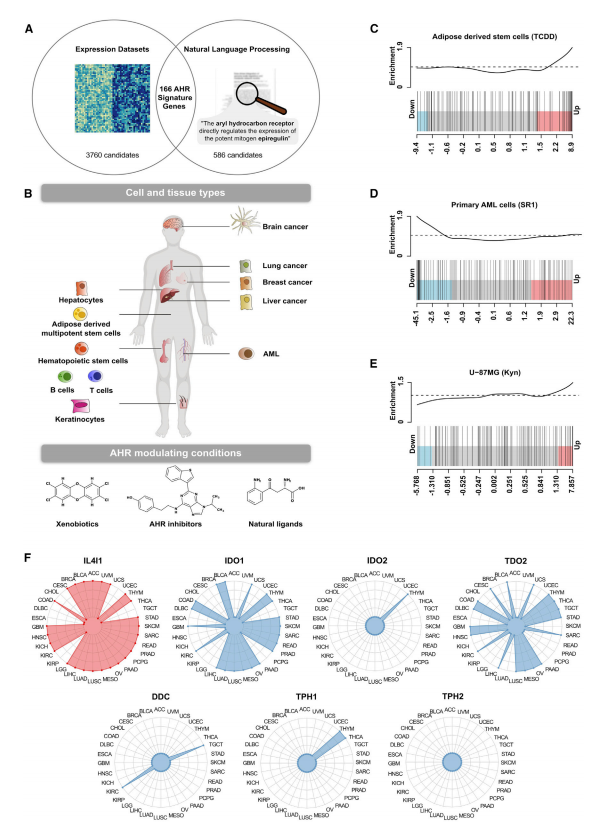
1.AHR泛组织信号适用于检测不同组织类型中AHR响应各种配体的活性,IL4I1与AHR活性的关联较IDO1或TDO2更为频繁。
研究者采取基因表达分析和自然语言处理(NLP)相结合的方法开发了一套AHR泛组织信号。一方面,研究者汇总了多个细胞类型经AHR激动剂或抑制剂处理后所产生的基因表达数据,还囊括了具有AHR启动子结合位点的基因数据。另一方面,研究者用NLP法提取了医学文献中与AHR调控有关联的基因名。这两组数据的交集,也就是166个受AHR调控的基因,被看作是AHR泛组织信号。GO富集分析表明这些基因代表了由AHR调节的主要细胞功能,包括药物代谢、迁移和免疫调节。在不同细胞类型和不同配体组合的数据集中验证AHR信号的可靠性,利用qRT-PCR检测胶质母细胞瘤(GBM)U-87MG细胞中AHR激活/敲低状态下部分信号基因的表达,结果表明在不同细胞类型中AHR信号均能检测到AHR响应各种配体的活性。
根据IDO1或TDO2的表达水平将32种TCGA肿瘤类型分为高表达和低表达组,多数肿瘤类型中,任一酶高表达组的AHR信号也得到增强。加权基因共表达网络分析(WGCNA)32个TCGA肿瘤类型中IDO1或TDO2的表达与AHR活性的相关性,23个肿瘤类型中IDO1和TDO2被分组到与AHR活性正相关的基因模块(AAM),9种癌症类型的AAM中没有IDO1和TDO2,说明有其它酶激活AHR。因此,研究者WGCNA分析了32个癌症类型中所有色氨酸(Trp)降解酶(TCE)与AHR的相关性,发现实际上L-氨基酸氧化酶IL4I1在AAM中出现频率最高,高于其它TCE。
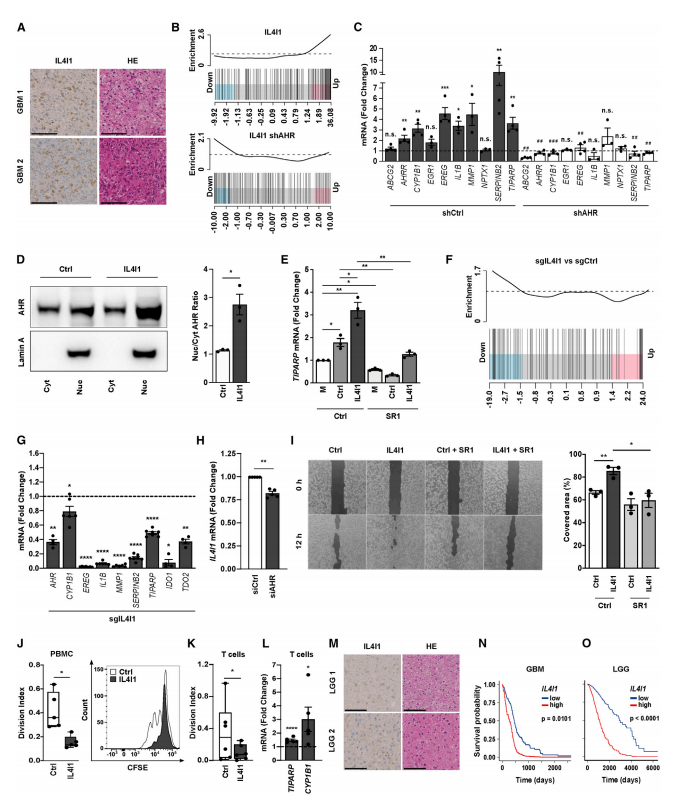
2.IL4I1可激活AHR、促进肿瘤细胞迁移、抑制T细胞增殖、并与胶质瘤患者存活率降低相关。
研究者研究了低内源IL4I1 GBM细胞(AHR正常型U-87MG和AHR缺陷型U-251MG)中过表达IL4I1和高内源IL4I1 GBM细胞中敲低IL4I1对AHR活性的影响。发现U-87MG中过表达IL4I1诱导增强了AHR信号,这一现象可被AHR敲低所逆转。此外,IL4I1衍生的代谢物也能激活AHR,增强其核转移并启动靶基因转录。相反,IL4I1下调使AHR信号减弱。下调AHR后IL4I1的表达被抑制,说明IL4I1本身是AHR靶基因。CAS-1细胞中沉默IL4I1基因能下调AHR靶基因TIPARP的表达,而沉默TDO2对TIPARP无明显影响,说明IL4I1直接对AHR进行调控,与TDO2无关,且IL4I1在这些细胞中是更有效的AHR激活酶。
过表达IL4I1增强U-87MG迁移能力,其可被AHR抑制子SR1逆转。过表达IL4I1对AHR缺陷型细胞迁移能力无影响。与对照组相比,过表达IL4I1细胞的上清液可抑制外周血单核细胞(PBMC)T细胞和CD8+ T细胞的增殖,同时诱导CD8+ T细胞中AHR靶基因TIPARP和CYP1B1的表达。生存率分析表明高水平的IL4I1与GBM和低分型胶质瘤(LGG)患者总体生存率降低显著相关。与IL4I1低表达组相比,IL4I1高表达的GBM和LGG患者均表现出升高的AHR活性,证实IL4I1与神经胶质瘤中AHR活性和患者生存期密切联系。
3.吲哚-3-丙酮酸(I3P)是介导IL4I1驱动的AHR活化和肿瘤恶化的关键代谢产物。
在体内代谢过程中,IL4I1催化苯丙氨酸(Phe)、酪氨酸(Tyr)和Trp分别转化为PP、HPP和I3P。分别将这些代谢产物处理AHR正常型细胞,PP和HPP不诱导AHR靶基因的表达,但I3P AHR依赖性地上调AHR靶基因。与之相符,I3P能诱导AHR核转移并增强外源反应元件(XRE)驱动的萤光素酶活性,而PP或HPP不能。接下来,研究者比较了激动剂I3P、Kyn和KynA激活AHR的能力。相较于Kyn或KynA,I3P能以较低浓度诱导XRE驱动的萤光素酶活性并上调TIPARP。大多数I3P调节的途径都是AHR依赖性的,I3P AHR依赖性地增强GBM细胞的迁移能力。CD8+ T细胞中I3P也能激活AHR并抑制T细胞增殖。因此,I3P是一种新的介导IL4I1和AHR驱动的肿瘤恶化的代谢物。
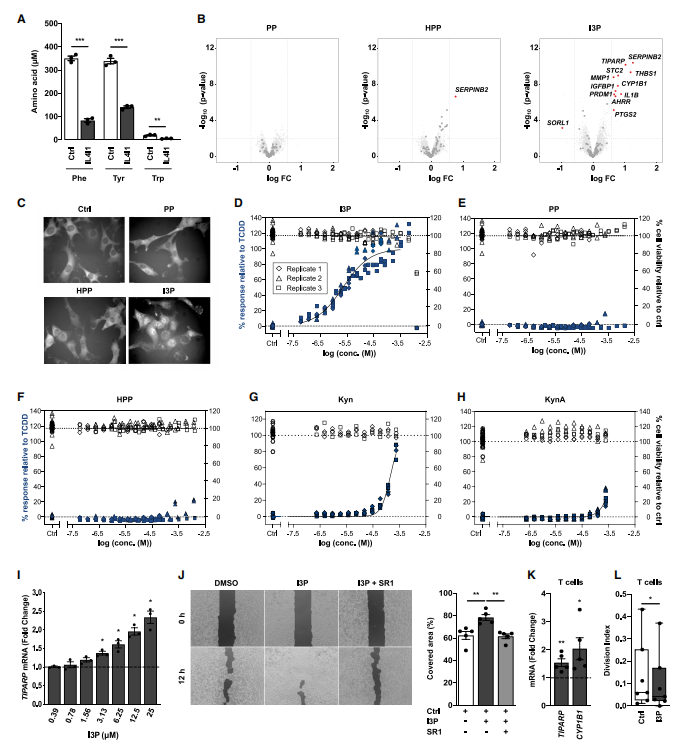
4.I3P提高AHR激动剂KynA和吲哚-3-乙醛(I3A)的水平。
在过表达IL4I1细胞的上清液中,研究者未检测到I3P,但检测到I3P的衍生物吲哚乙酸(IAA)、I3A、吲哚-3-乳酸(ILA)显著上调。经典理论认为KynA是由IDO1或TDO2代谢的Kyn衍生而来,而该研究发现IL4I1过表达能提高细胞中KynA水平,但对Kyn无影响。IL4I1对KynA的调节作用在小鼠脾脏组织中得到进一步证实。与野生型(WT)小鼠相比,Il4i1敲除小鼠的KynA水平显著降低。用I3P处理GBM细胞导致细胞中IAA、I3A和KynA水平呈剂量依赖性增加,证实这些代谢物均源自I3P。I3P转化成KynA的一种可能路径是Kyn的氨基转移。泛氨基转移酶抑制剂能完全消除对照组中KynA的形成,但仅使过表达IL4I1细胞的KynA水平降低了约70%,说明被消减的这部分KynA来源于Kyn的氨基转移,而剩下的约30%KynA可能来源于I3P,因为在无细胞条件下I3P能自发地形成KynA。IL4I1衍生物H2O2能促进I3P向KynA的转化。I3P衍生物I3A能诱导TIPARP并上调AHR泛组织信号。以上结果表明,IL4I1通过I3P的产物KynA和I3A激活AHR。
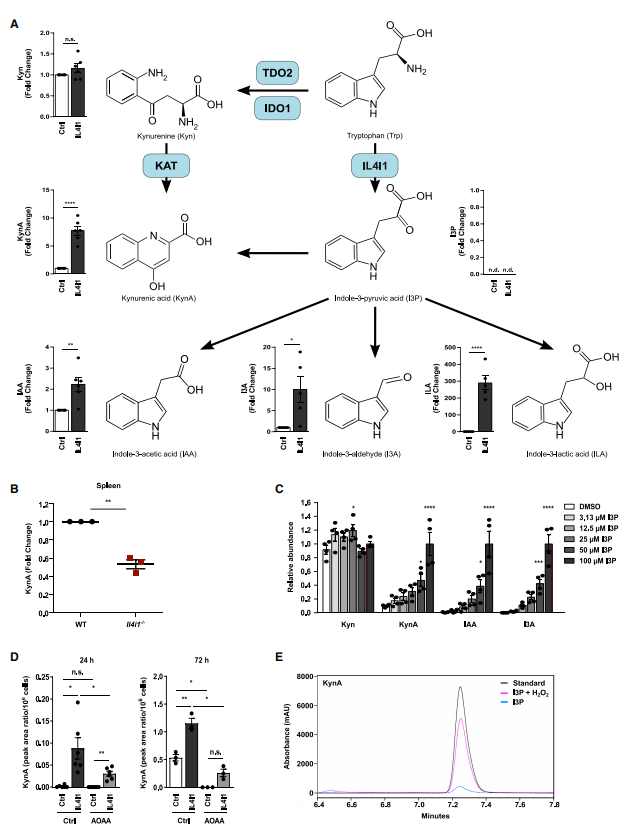
5.IL4I1表达在原发癌症和转移性肿瘤中增强。
大多数肿瘤类型中,与健康组织相比,原发癌组织的IL4I1表达增强,弥漫性大B细胞淋巴瘤中的IL4I1表达尤甚。此外,多数癌症类型中IL4I1表达高于IDO1或TDO2,突显IL4I1是癌症的主要TCE。过表达IL4I1的细胞中,AHR靶基因的表达并未受到低氧环境的影响,说明IL4I1在低氧肿瘤微环境(TME)中也可以激活AHR。与原发性黑色素瘤相比,转移性黑色素瘤的IL4I1水平和AHR活性更高。与此一致地是,新鲜切除的转移性黑色素瘤组织中能检测到IL4I1酶活性。尽管IL4I1增强细胞迁移能力并在转移性肿瘤中富集,GO富集分析表明,含有IL4I1的AAM富集的功能中,迁移只是第三富集的功能,免疫调节作用是首要富集的功能,这与IL4I1抑制T细胞增殖的行为一致,说明IL4I1在癌症中的免疫调节功能更为显著。
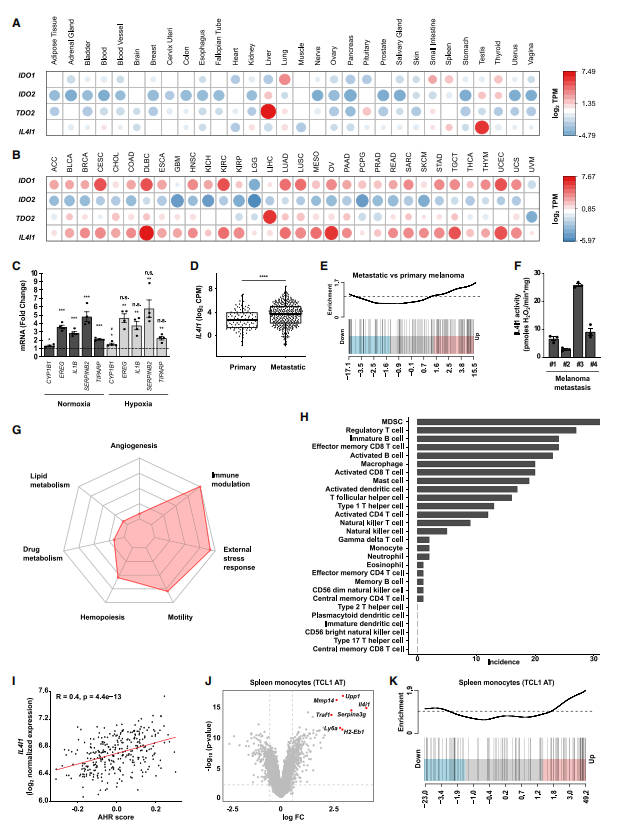
6.IL4I1是代谢性免疫检查点,因而促进CLL恶化。
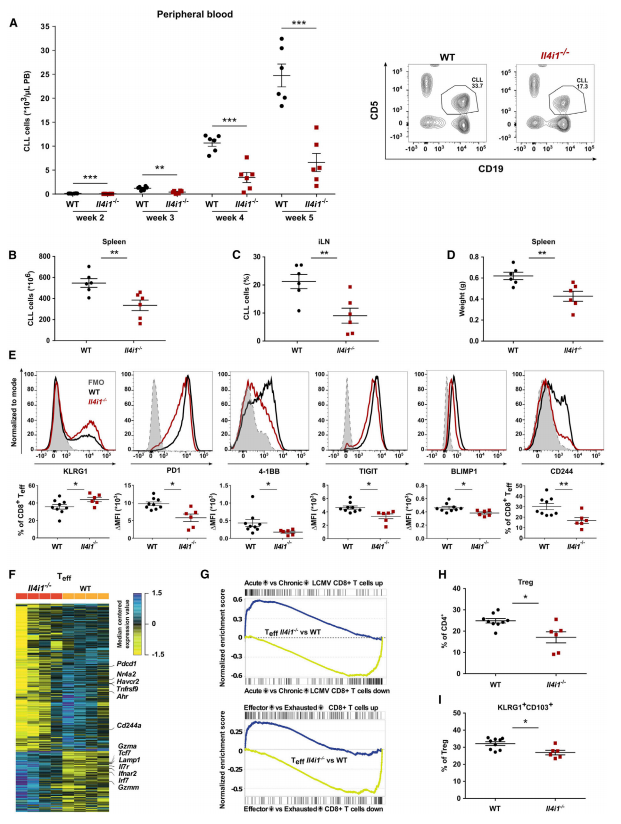
高表达IL4I1的肿瘤中免疫抑制性细胞富集,比如髓源抑制性细胞(MDSC)和Treg细胞。多组学因子分析也证实了这一点,含有IL4I1的模块与MDSC和Tregs密切相关。CLL是一种表达IL4I1的B细胞淋巴瘤,CLL复发的患者中,IL4I1表达与AHR活性相关,说明侵袭性CLL可用于IL4I1的研究。研究者研究了侵袭性CLL小鼠模型(TCL1 AT)中,IL4I1对肿瘤发展和抗肿瘤免疫应答的影响。与无肿瘤对照相比,Il4i1是疾病小鼠的肿瘤应援单核细胞中上调程度最高的基因之一,且其表达随着AHR活性的增强而增加。血清中IL4I1水平在疾病小鼠中也升高。与野生型疾病小鼠相比,Il4i1缺陷型疾病小鼠在外周血、脾脏和腹股沟淋巴结中的肿瘤负荷降低,并且脾脏重量下降,表明IL4I1在肿瘤免疫逃逸中的作用。研究者进一步观察了疾病小鼠中的TME,发现Il4i1缺陷型小鼠中有更高比例的经典树突状细胞(cDC),说明Il4i1缺陷型小鼠有更强的抗原呈递能力。
扩增的CD8+效应T细胞(Teff)控制TCL1 AT小鼠的肿瘤发展,但逐渐丧失效应功能并显示出T细胞耗竭的表型。IL4I1缺陷减轻了TCL1 AT小鼠Teff的耗竭,表现为KLRG1(活化的Teff的标志物)高表达、与免疫疲劳相关的免疫调节受体低表达、更高比率的PD1中等表达程度的CD8+ T细胞。对来源于野生型和Il4i1缺陷型疾病小鼠的Teff和CD8+记忆T细胞进行转录组分析,证实Il4i1缺陷型中与免疫疲劳相关的免疫调节受体和Ahr基因下调,Teff基因上调。基因集富集分析(GSEA)显示,相较于慢性淋巴细胞性脉络膜脑膜炎病毒(LCMV)感染的Teff,急性LCMV感染的Teff的富集结果与Il4i1缺陷型Teff的富集结果类似。干扰素应答是Il41i1缺陷型Teff中基因富集最多的功能之一。以上数据表明,TME中IL4I1缺陷可改善CD8+ T细胞功能。Il4i1缺陷型中Treg细胞、KLRG1+CD103+ Treg细胞和CTLA4+ Treg细胞的比例均下降。综上,在Il4i1缺陷型TME中,肿瘤相关T细胞所表现出来的特性说明IL4I1是一个抑制获得性免疫应答的代谢性免疫检查点。
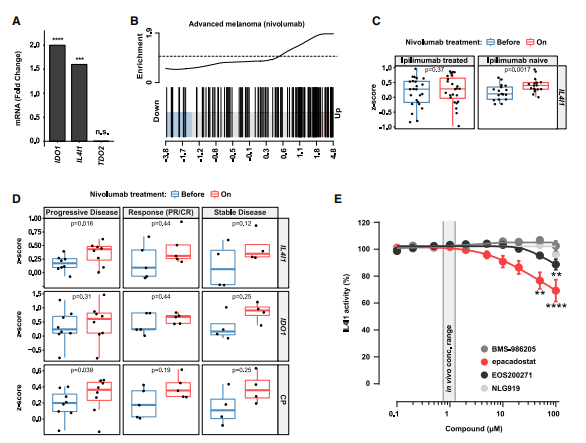
7.免疫检查点阻断诱导IL4I1表达。
抗PD1的单抗nivolumab能诱导晚期黑素瘤中IL4I1和IDO1的表达,并激活AHR。转录组分析41位患者nivolumab治疗前后的样本数据(有24位患者在nivolumab给药前接受过抗CTLA4单抗ipilimumab的治疗),未经ipilimumab治疗的患者中nivolumab治疗使IL4I1显著增加。进一步观察这些未经ipilimumab治疗的患者中nivolumab给药后肿瘤的状态,肿瘤恶化的患者中IL4I1和免疫检查点分子水平显着升高,暗示IL4I1诱导代表了一种抗ICB的耐药机制。IDO1抑制剂BMS-986205、依帕卡司他、EOS200271和NLG919在其体内浓度下均不能抑制IL4I1的酶促活性。以上结果表明,ICB治疗中IL4I1可介导IDO1抑制剂抗性。