文献解读│CUSABIO产品荣登Nature Medicine:溃疡性结肠炎中结肠CD8 + T细胞的单细胞图谱
日期:2020-09-17 11:29:59


研究背景及目的
结肠内抗原接触的淋巴细胞(如组织驻留记忆CD8+T细胞)可对重复的抗原暴露迅速做出反应。但是,这些CD8+T细胞的细胞表型及其驱动免疫调节和炎症的机制仍不清楚。用单细胞转录组学与T细胞受体库分析和质谱分析技术,研究人员绘制了健康和溃疡性结肠炎(UC)中人结肠CD8+ T细胞图谱,确定健康和UC中的结肠CD8+ T细胞表型,定义不同细胞亚群之间的克隆关系,表征UC中表达IL-26的功能缺陷的终末分化CD8+ T细胞。
结论
CD8+ T细胞组成存在广泛的异质性,包括扩增的效应子和“后效应子”终末分化的CD8+ T细胞。UC相关的CD8+效应细胞可以触发肠道损伤并产生肿瘤坏死因子TNF-α,而后效应细胞的先天特征,可能有助于后效应细胞获得调节功能来减轻过度的炎症反应。在急性炎症反应中IL26具有保护作用。
结果
1.结肠CD8+ T细胞具有高度异质性,UC患者的结肠CD8+ T细胞组成存在结构性变化,UC改变CD8+细胞与上皮细胞的交互应答
利用单细胞测序比较健康志愿者及UC结肠CD8+ T细胞转录组谱,利用UMAP算法将CD8+ T细胞分为14个细胞亚群。GO富集和基因表达丰度分析显示CD8+CD4+亚群具有IL-17通路活性,而IEL和IL26+细胞具有NK通路活性,说明结肠CD8+ T细胞具有广泛异质性。与健康细胞相比,UC结肠CD8+ T细胞中,TRM细胞比例显著减少,GZMK+效应细胞及IL26+细胞比例显著增加。此外,UC中 CD4+CD8+FOXP3+亚群增多,先天TYROBP+ IEL亚群减少,扩增的TYROBP- IEL亚群诱导增多。多数差异基因只存在于一种亚群中,有34个基因在四个以上的亚群中差异表达,这些基因包括在TRM、效应细胞和IEL细胞中下调表达的SPINK2、FOS、CD160和上调表达的TNFRSF9和CTLA4,反映出炎症性肠病(IBD)形成过程中效应细胞具有不同的通路活性。利用转录谱数据进行结肠内IBD遗传易感位点分析显示,UC相关位点的GWAS基因在14个亚群中高度富集,富集程度最高的是TYROBP- IEL和IL26+细胞。
依据差异表达的受体和配体对,研究人员在UC中共鉴定到1716个交互作用的改变。UC结肠细胞中HLA-E在多个上皮细胞亚群中上调,对应的配体在CD8+ T细胞中上调。谱系特异性相互作用包括IL18-IL18R1/IL18RAP和TNF-TNFRSF1A信号分子在吸收细胞和CD8+细胞亚群中线性表达。虽然IL-26在所有组织都表达且与炎症反应程度正相关,IL-26受体IL10RB/IL20RA在上皮细胞、间叶细胞、免疫细胞中均表达较低,说明IL-26在UC中的高表达并不是由其受体造成的。
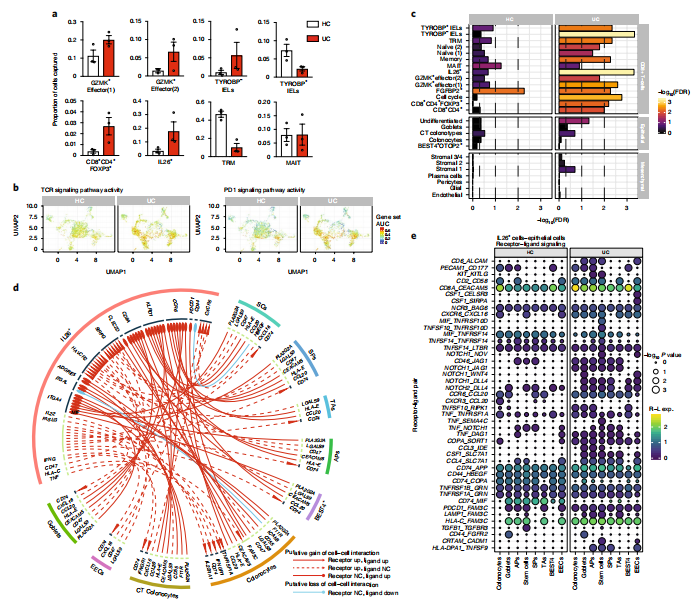
2.转录调控网络主导UC结肠CD8+细胞的可塑性,TCR profiling揭示不同CD8+细胞亚群之间的联系
基因共表达分析共鉴定到273个转录因子活性相关的基因表达模块。EGR1和EGR2所在的一类基因模块,它们的活性处于TRM向GZMK+效应细胞转换的区域,与炎症因子IFNG、TNF和早期反应转录因子共表达,暗示CD8+ T结肠细胞中,分泌EGR的T细胞能迅速被激活并对大多数致病性TNF做出反应的机制。
UC中富集的GZMK+效应细胞和IL26+细胞具有T细胞耗竭的特征,标志着CD8+ T细胞的肿瘤浸润。这种现象表征为共抑制分子HAVCR2、LAYN、ENTPD1、CTLA4、PDCD1和转录因子TOX和EOMES一致性表达,说明UC中IL26+ CD8+细胞具有慢性激活的特性。
仿时间分析将时间共变基因分为早期、中期/中晚期、晚期表达基因。Na?ve细胞和早期中央记忆T细胞的标记分子(如CCR7)早期表达,共抑制受体(HAVCR2,CTLA4)较晚表达。TCR profiling分析揭示,UC中,未扩增的细胞在仿时间轨迹的起点富集,而大部分扩增的T细胞克隆在仿时间轨迹的终点富集。
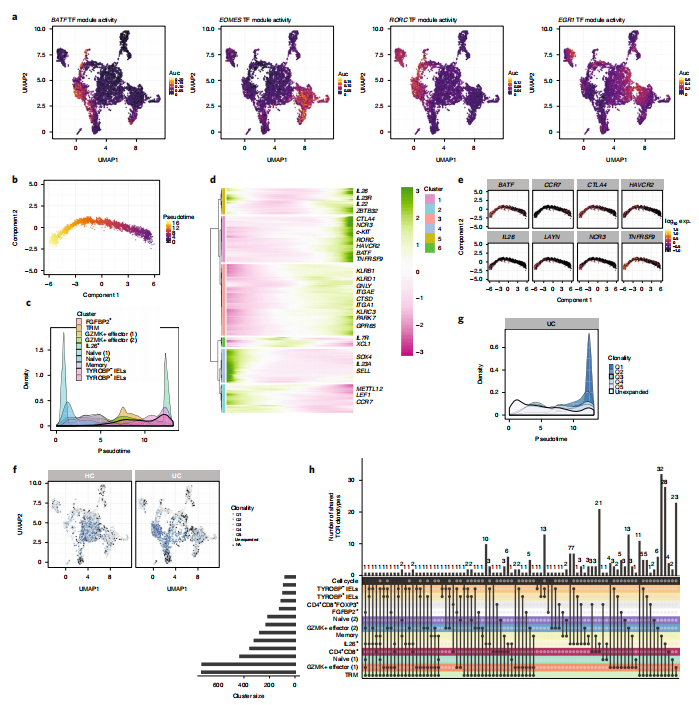
3.UC中获得性IL26+细胞显示先天性特征
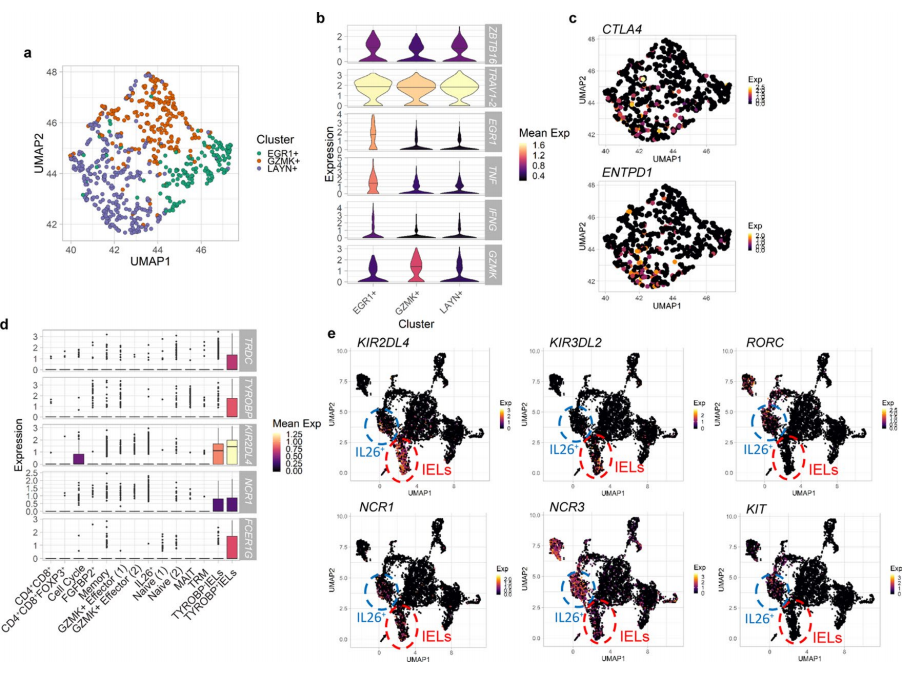
单细胞谱鉴定到包括MAIT细胞和γδ IELs在内的先天CD8+淋巴细胞簇。虽然MAIT细胞几乎没有异质性,但在UC中,它们活化程序与常规CD8 +细胞类似,包括早期反应基因EGR1和EGR2与TNF和IFNG的共表达,以及以共抑制分子和共刺激分子表达为表征的细胞状态转换。Vδ1 γδ细胞在CD8+ IEL亚群中占有很高比例,但TCR-αβ细胞也大量表达先天免疫细胞标志分子,例如杀伤细胞免疫球蛋白样受体(KIR)(如KIR2DL4和KIR2DL2),NK细胞受体(如NCR1)和FCER1G。研究人员发现MKI67+细胞表达了部分以上基因,说明UC中IEL亚群正在获得增殖活性。通过结肠上皮细胞scRNA-seq研究捕获的T细胞种群富集有IEL细胞,研究人员对先天性IEL细胞进行了分析,发现这些细胞大部分是CD8+细胞,仅存在少量CD4+细胞。基于TYROBP的表达将IEL细胞分为自然型和诱导型IEL细胞,UC中观察到IEL细胞存在向诱导型转变的偏好。研究人员还发现在UC中增多的获得性CD8+ IL26+细胞也显示出不同于IEL转录谱的先天性特征,IL26+细胞缺少KLRC2和IEL特异性KIRs标记分子,确表达谱系阴性先天性淋巴细胞2型ILC3的标记分子和转录因子。这些结果表明CD8+ IL26+细胞虽然谱系阳性确具有杂合型Tc17和2型ILC3细胞的特性。
4.多组学分析证实UC中CD8+ T细胞异质性和重塑
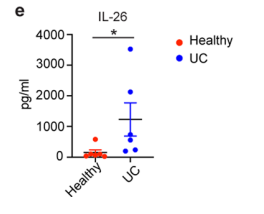
研究人员利用CITE-seq结合cell hashing技术证实scRNA-seq中CD8+ T细胞亚群分类的可靠性,证实了不同亚群之间组织驻留与迁移偏好的差异,并利用ELISA证实IL-26蛋白在UC结肠CD8+ T细胞中上调表达。
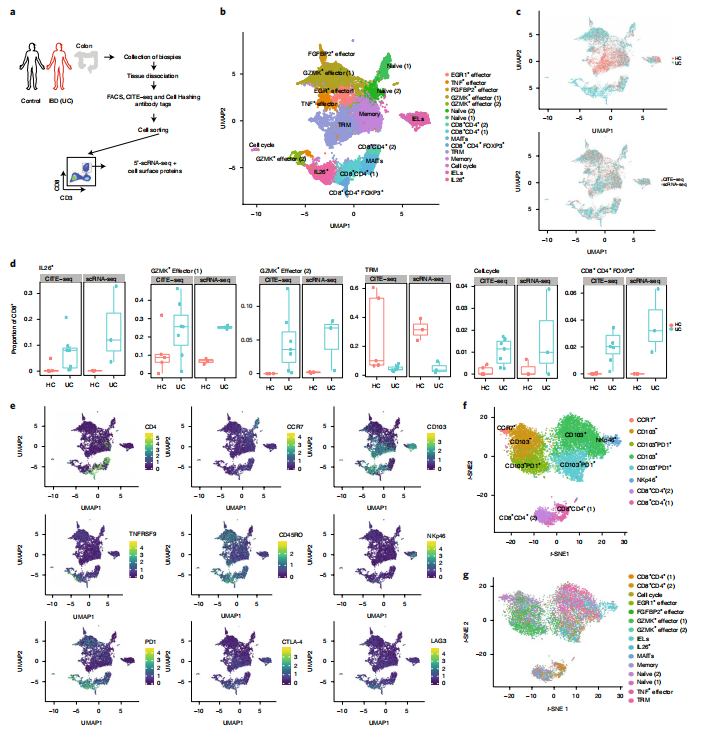
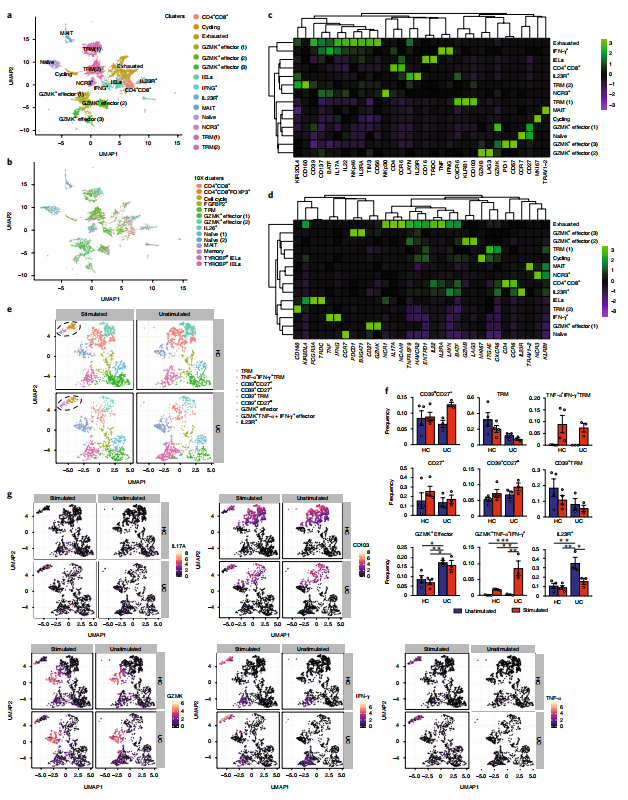
5.多维度分析UC中CD8+细胞亚群功能
利用质谱流式细胞技术,研究人员将39个标记分子整合到scRNA-seq的细胞分类中,将CD8+ T细胞细分为19个亚群。体外细胞激活实验证实CD8+ T细胞活化后,表达TNF-α和IFN-γ的CD103+ TRM细胞亚群在健康和UC结肠细胞中均开始富集,而GZMK+效应细胞只在UC结肠细胞中富集。很少有IL23R+细胞(主要包括IL26+,一些MAIT和DP细胞)对PMA+ionomycin刺激作出反应,符合其转录的“后效应子”终末分化特征。IL-17在UC IL23R+/IL26+细胞中低表达,但UC CD8+细胞的激活能诱导IL-17在缺失IL23R但TNF-α/IFN-γ阳性的亚群中表达。
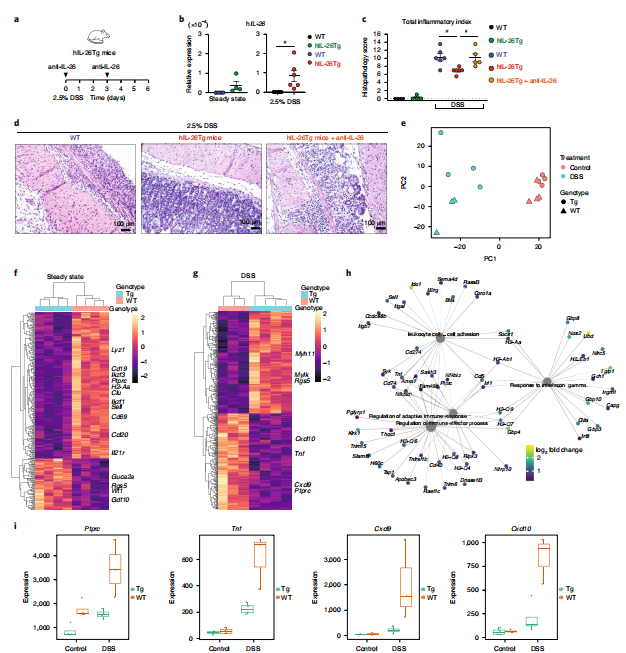
6.人源化小鼠模型中,人IL-26的表达可缓解DSS诱导的结肠炎,IL-26抗体处理可逆转
利用DSS处理小鼠,相比野生型小鼠,用对照单抗处理过的hIL-26Tg小鼠的炎症指标显著降低,而用IL-26单抗处理可使炎症指标回升,暗示IL-26在急性炎症反应中具有保护作用。对小鼠的健康结肠组织和经DSS处理过的结肠组织进行RNA-seq,GO富集分析表明野生小鼠中与T细胞和B细胞活化以及白细胞增殖相关的基因富集,而Tg小鼠中富集程度明显降低,说明即使在非炎性条件下,IL26也能降低粘膜的免疫浸润或下调激活和增殖信号。经DSS处理过的小鼠中,炎症信号分子在hIL-26小鼠中显著下调。
助力论文频频上榜高分期刊Cell、Nature Medicine、Nature Cell Biology、Nature Communications、Basic Research in Cardiology、Protein & Cell……等等~
上一篇: CD47:下一个肿瘤免疫研发热点











