识别Treg细胞的身份,你可以这样做
日期:2019-12-20 14:05:46
免疫系统能准确地识别“自己”与“非已”,使机体产生保护性免疫应答,实现对肿瘤的监视。
Treg细胞就是调节性T细胞(regulatory T cells),是免疫系统中的基本细胞,是Sakaguchi等人[1]于1995发现的,以表达Foxp3、CD25、CD4为细胞表型特征。它是Th1、Th2、Th17之外的T细胞亚群,属于一类增殖能力较低的CD4+ T细胞亚群,具有免疫抑制作用,能够分泌IL-4、IL-10和TGF-β等细胞因子,在免疫稳态和诱导免疫耐受中发挥重要作用。Treg细胞在感染、肿瘤、器官移植、预防自身免疫疾病、维持机体免疫平衡等方面具有重要作用。
1. Treg细胞的分类
Treg细胞目前没有统一分类,根据其来源,调节性T细胞可进一步分为自然调节性T细胞(natural regulatory T cell,nTreg)和适应性或诱导性调节性T细胞(adaptive regulatory T cell,aTreg 或induced regulatory T cell,iTreg)。
自然调节性T细胞(nTreg)主要为CD4+Treg细胞,由来自于骨髓中的祖细胞在胸腺中分化,约占总CD4+T淋巴细胞数的1%-3%,占外周血CD4+T淋巴细胞总数的5%-10%[2],在外周血、淋巴器官、炎症部位以及肿瘤组织中发挥免疫调节作用[3]。
aTreg或iTreg包括:Th3(表型特征为CD4+CD25low),Tr1(表型特征为CD4+CD25lowCD45RBlow),CD8+调节性T细胞、自然杀伤性T细胞(natural killer T,NKT)等多种亚型,它们与自身免疫性疾病的发生以及肿瘤的发生、发展密切相关。
iTreg由外周成熟T细胞受到特异性抗原刺激并在免疫抑制细胞因子(主要包括TGF-β、IL-2、IL-10、IFN-γ、IFN-α、吲哚胺2-3双加氧酶、以及维生素A代谢产物视黄酸)的诱导下分化而来的一类调节性T细胞,又称作sTreg,约占总CD4+T细胞数的4%-7%。
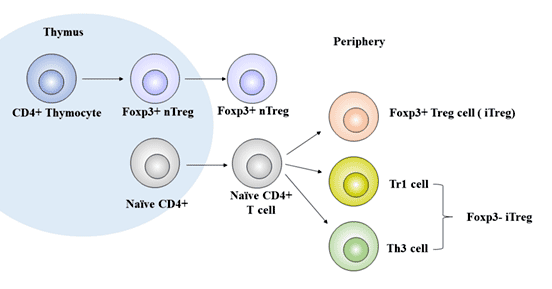
图1 Treg细胞的发育
2. Treg细胞的分化
Treg细胞的分化发育和功能的发挥也受多种细胞因子的调节。转录因子叉头盒P3(Foxp3)参与Treg细胞的分化。转录激活子STAT5是参与Treg细胞分化与存活的另一重要因素。
nTreg的胸腺发育取决于TCR与CD28的协同刺激,CD28对于外周的nTreg的稳态增殖和存活是必不可少的。iTreg的发展需要IL-2和转化生长因子(TGF-β),而不是与CD28协同刺激[4]。
研究表明,IL-2通过STAT5促进诱导性调节性T细胞的产生,而且IL-2与TGF-β共同诱导初始的CD4+CD25- T细胞转化为CD4 +CD25+ T细胞并表达Foxp3[5]。
3. Treg细胞的标志物
目前认为,CD4+CD25+ Foxp3+是Treg细胞的主要表型。
Treg还低表达特异性标志CD127。
Treg表面还表达一些受体,如CD5、CD38、CD45、CD62L、CD103、CTLA-4以及抑制性免疫受体GITR等。
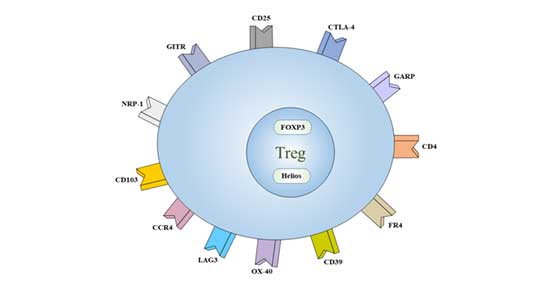
图2 Treg细胞的标志物
3.1 Intracellular Markers
FOXP3:Fontenot JD等[6]发现Treg细胞高表达叉头状/翼状螺旋转录因子3(forkhead box P3, Foxp3),它可促进未致敏CD4+T细胞转化为Treg[7]。
FOXP3是叉头样转录因子家族中的成员,和细胞生长发育的调控有关。FOXP3与Treg细胞密切相关。如果FOXP3基因发生突变,将影响Treg细胞的发育成熟,并引发某些疾病。
FOXP3主要表达于胸腺、脾脏和淋巴结等淋巴器官和组织。目前,Foxp3是目前公认的Treg细胞的最敏感的标志。
Helios:该基因编码锌指蛋白Ikaros家族的一个成员,是造血特异性转录因子,参与淋巴细胞发育的调节。这种蛋白与其他Ikaros家族成员形成同型或异型二聚体,被认为在早期造血发育中起主要作用。
3.2 Extracellular Markers
CD4:CD4,也称为T4/Leu-3,是免疫球蛋白超家族的成员。它是一种单链I型跨膜糖蛋白,分子量为55 kDa。
CD4β是TCR/CD3复合物的一部分,与MHCII类分子的β2结构域结合,参与TCR信号转导。它也可作为IL-16的受体,人类免疫缺陷病毒(HIV)和人类疱疹病毒7(HHV-7)的辅助受体。
CD25:CD25又被称为IL-2Rα,Ly-43,P55或Tac,是一种糖蛋白,分子量为55 kDa。它在活化的T和B细胞,胸腺细胞亚群,前B细胞和T调节细胞上表达。
CD39:CD39即核苷三磷酸二磷酸水解酶-1(nucleoside triphosphate diphosphohydrolase-1, NTPDase 1),是一种胞外酶,可将ATP降解为AMP。CD39表达于B细胞、树突状细胞和包括调节性T细胞和记忆性T细胞在内的T细胞亚群。CD39是免疫系统中这个家族的主要成员,参与抑制炎症和控制血小板激活。
CD62L:CD62L称为L-选择素或LECAM-1,是分子量为74-95 kDa的单链I型糖蛋白。它表达在大多数外周血B细胞,T细胞和NK细胞亚群,单核细胞,粒细胞和某些造血系统恶性肿瘤细胞上。
CD73:CD73是一种通过GPI锚定在细胞上的细胞表面蛋白,分子量为69 kDa。在小鼠中,CD73在骨髓中的表达仅限于CD11b+髓细胞。在脾脏中,它主要在T细胞上表达。
CD103:CD103又称为αE整合素或整合素αIEL链,属于整合素家族的一员,是一种I型跨膜糖蛋白。T调节细胞高表达CD103。CD103与E-cadherin结合,介导淋巴细胞归巢到肠上皮细胞。
CD134:CD134是TNF受体家族的一员,又称OX40和TNFRSF4,是一种50 kDa的I型跨膜糖蛋白。OX40表达在活化的T淋巴细胞上。OX40与OX40L的相互作用导致B细胞增殖和抗体分泌,调节原代T细胞增殖和T细胞存活。OX40影响CD4+T细胞耐受性的调节。
CD152 (CTLA-4):CD152是免疫球蛋白超家族成员,也被称为CTLA-4或Ly-56,其分子量为33 kDa。它在活化的T淋巴细胞和B淋巴细胞上表达。
CTLA-4负调控细胞介导的免疫反应,在诱导和维持免疫耐受、发展保护性免疫和调节胸腺细胞方面发挥作用。
CD194 (CCR4):CCR4配体包括:CCL17(TARG)和CCL22(MDC)结合。它表达于记忆T细胞、巨噬细胞、血小板、嗜碱性粒细胞、Th2细胞和Treg细胞。
CCR4及其配体(CCL17和CCL22)在各种皮肤免疫疾病中对记忆T细胞的募集起重要作用。
FR4:叶酸受体4(FR4)是叶酸(维生素B9)的表面受体。它在小鼠CD4+CD25+天然调节性T细胞(Treg)上具有高的组成性表达。它可与CD4、CD25结合,将Treg与其他类型的T细胞区分开来。
GARP:GARP,又称富含亮氨酸重复序列32(LRC32),是一种分子量为80 kDa的I型膜糖蛋白。GARP存在于巨核细胞、血小板和活化的Treg(CD4+,CD25+,FoxP3+细胞)表面,是潜伏的转化生长因子-β的受体。GARP可能在控制Tregs的抑制功能中发挥作用。
GITR:GITR(糖皮质激素诱导的TNFR相关基因)也称为TNFRSF18和AITR,是TNF受体超家族的成员。它在CD25+CD4+Tregs上高水平表达。GITR与其配体的相互作用能增强T细胞的活化、增殖、细胞因子的产生,并消除CD25+CD4+Tregs的抑制功能。体内GITR的激活导致自身免疫性疾病的发生,并恢复被抑制的免疫反应。
TGF-β:TGF-β是成骨细胞形成的一个强有力的刺激物,在骨重塑中扮演着重要的角色。
它可调节Th17细胞或Treg细胞谱系分化。高浓度时有利于Treg细胞的发育。低浓度与IL-6、IL-21协同作用,有利于Th17细胞的分化。它还在许多细胞类型中控制细胞增殖、分化和其他功能。
CD127不表达或弱表达:CD127也称为IL-7受体α链或IL-7Rα,是一种分子量为60-90 kDa的I型跨膜糖蛋白。CD127在Treg细胞上表达下调,缺乏CD127是Tregs细胞的特征之一。它可以作为Treg和常规T细胞分化的标志。
4. Treg的生理功能
Treg的一般生理功能主要包括以下几个方面:
免疫耐受:Treg通过抑制自身反应性T细胞而使机体对自身抗原产生主动的耐受,防止自身免疫疾病的发生。在肿瘤中,Treg通过免疫抑制作用使机体对肿瘤产生抗原耐受,从而使肿瘤细胞逃脱机体的免疫杀伤。
促使炎症反应趋向慢性:当病原体侵入时,机体的效应性T细胞会通过一系列免疫反应清除病原体,而Treg在机体中扮演着与其他免疫细胞相反的角色[8],Treg细胞的特征是在各种免疫细胞亚群中分泌发挥抑制功能的细胞因子。可以防止引起组织破坏的病理性免疫应答发生,然而同时也是病原体长期存在难以清除的因素,延长了慢性感染的病程。
免疫抑制作用:Treg的主要功能就是对机体的免疫反应起到负性调节作用,也因此Treg在调节机体免疫稳态和阻止自身免疫性疾病发生方面起了至关重要的作用。
Treg细胞调节免疫机能并参与人体的衰老过程。衰老过程中小鼠的免疫机能下降。
Treg通过对自身抗原的免疫耐受而防止自身性免疫疾病的发生。同样,通过免疫抑制作用,Treg促使肿瘤发生免疫逃逸[9],因此也被视为一种帮助肿瘤幸存并促进其生长的免疫细胞。

图3 Treg细胞的免疫抑制作用
5. Treg细胞的调节机制
Treg发挥免疫调节功能主要通过两种方式:
5.1 细胞间直接接触
某些趋化因子使Treg聚集在免疫细胞周围,通过细胞间接触依赖机制发挥作用。Treg可通过CTLA-4、TGF-β及GITR等直接与靶细胞上的相应受体结合,抑制CD4+T、CD8+T、树突状细胞、抗原提呈细胞等免疫细胞增殖[10]。
Treg通过调节树突状细胞的数量和活性,使其抗原提呈作用失效而抑制机体免疫反应。
在乳腺癌患者体内的研究表明,Treg的过度表达可能会下调细胞毒性T淋巴细胞,降低其对肿瘤细胞的杀伤作用,使肿瘤细胞发生免疫逃逸。
Treg通过抑制T淋巴细胞产生某些增强机体免疫效应的细胞因子发挥免疫抑制作用。
Treg还可通过细胞毒T淋巴细胞相关抗原4(cytotoxic T lymphocyte-associated antigen-4, CTLA-4)诱导T细胞无反应性,抑制免疫反应。
5.2 分泌抑制性细胞因子
Treg通过分泌抑制性细胞因子,如IL-4、IL-10、IL-35和TGF-β对免疫实现负性调控[11][12]。
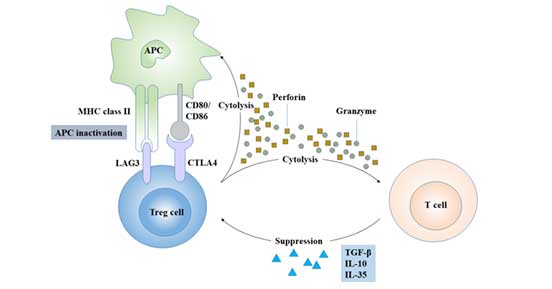
图4 Treg细胞的调节机制
6. Treg细胞与肿瘤
肿瘤微环境在肿瘤的发生发展中起着非常重要的作用,免疫细胞可通过影响肿瘤微环境而影响肿瘤的进展。
一方面,大部分免疫细胞可发挥抗肿瘤免疫作用。如辅助性T细胞和细胞毒性T细胞。另一方面,Treg在肿瘤微环境中却扮演着相反的角色。Treg的免疫抑制作用既能防御人体发生自身免疫性疾病,又能促使肿瘤细胞发生免疫逃逸,间接加快了肿瘤细胞的增殖,增强了肿瘤细胞的浸润能力。
Treg细胞可以抑制识别自身肿瘤细胞的效应细胞的发育和活化,在介导机体肿瘤免疫耐受中起重要作用。研究表明,Treg细胞的数量与肿瘤的预后呈负相关[13]。
Treg细胞诱导肿瘤的免疫耐受是通过控制初级T细胞及记忆性T细胞实现的。
许多细胞因子也与肿瘤的免疫耐受有关。Treg细胞还可通过TGF-β影响CD4+(Th1,Th2、Th17、NK)等免疫细胞而导致宿主出现免疫耐受。
Treg细胞诱导肿瘤的免疫耐受还与树突状细胞(DC)的作用相关[14]。
7. Treg细胞与免疫治疗
Treg细胞在机体的免疫中起到免疫抑制的作用,这一特性在骨髓移植治疗中倍受青睐。
多发性骨髓瘤患者在进行骨髓移植时,低淋巴状态可提高患者移植成功率。
Treg细胞介导机体对抗原产生耐受,它的数量减少会使机体对自身某些抗原的耐受性下降,增加对移植物的排异反应。因此,刺激人体内的Treg细胞的恢复及再生,可使患者对于移植物的排异反应明显减少,大大提高了骨髓移植的成功性。
同样,Treg细胞的免疫抑制作用与肿瘤抗原的免疫逃避及耐受相关。因此在肿瘤中,如何降低Treg的功能是关键。
IL-2对Treg细胞的发育至关重要[15]。IL-21是一种结构类似于IL-2,但却没有免疫调节机能的细胞因子。使用IL-21替换IL-2,可阻止Treg细胞发育成sTreg细胞。此外,抗CD25+单克隆抗体及抗CD4+单克隆抗体的联合应用可封闭体内的Treg细胞,最大限度地消除Treg细胞的作用。小鼠实验证明,Treg细胞去除越完全肿瘤免疫治疗效果越好,小鼠的生存期越长[16]。
肿瘤免疫治疗的另一个思路即逆转Treg细胞诱导的对肿瘤细胞的免疫耐受。
Kiniwa等[17]发现TLR8配体可以逆转Treg细胞对肿瘤的免疫无能性,消除肿瘤的免疫逃避,提高效应细胞效能。研究发现当机体内缺乏共刺激因子B7.1及B7.2时,肿瘤细胞就会逃避机体的免疫监视,使T细胞出现无能状态或诱导其调亡,致使肿瘤无限制地生长。良好的B7.1活性可以逆转Treg细胞对肿瘤的免疫耐受,消除对效应细胞的抑制,提高杀伤效果。
References
[1] Sakaguchi S, Sakaguchi N, Asano M, et al. Immunologic self-tolerance maintained by activated T cells expressing IL-2 receptor alpha-chains (CD25). Breakdown of a single mechanism of self-tolerance causes various autoimmune diseases [J]. The Journal of Immunology, 1995, 155(3): 1151-1164.
[2] Gavin M A, Rasmussen J P, Fontenot J D, et al. Foxp3-dependent programme of regulatory T-cell differentiation [J]. Nature, 2007, 445(7129): 771.
[3] Feuerer M, Hill J A, Mathis D, et al. Foxp3+ regulatory T cells: differentiation, specification, subphenotypes [J]. Nature immunology, 2009, 10(7): 689.
[4] Cassis L, Aiello S, Noris M. Natural versus adaptive regulatory T cells [M]. Kidney Transplantation: Strategies to Prevent Organ Rejection. Karger Publishers, 2005, 146: 121-131.
[5] Zheng S G, Wang J, Wang P, et al. IL-2 is essential for TGF-β to convert naive CD4+ CD25- cells to CD25+ Foxp3+ regulatory T cells and for expansion of these cells [J]. The Journal of Immunology, 2007, 178(4): 2018-2027.
[6] Trzonkowski P, Szmit E, Myśliwska J, et al. CD4+ CD25+ T regulatory cells inhibit cytotoxic activity of T CD8+ and NK lymphocytes in the direct cell-to-cell interaction [J]. Clinical immunology, 2004, 112(3): 258-267.
[7] Li Z, Li D, Tsun A, et al. FOXP3+ regulatory T cells and their functional regulation [J]. Cellular & molecular immunology, 2015, 12(5): 558.
[8] Klabusay M. The role of regulatory T-cells in antitumor immune response [J]. Klinicka onkologie: casopis Ceske a Slovenske onkologicke spolecnosti, 2015, 28: 4S23-7.
[9] Halvorsen E C, Mahmoud S M, Bennewith K L. Emerging roles of regulatory T cells in tumour progression and metastasis [J]. Cancer and Metastasis Reviews, 2014, 33(4): 1025-1041.
[10] Schlößer H A, Theurich S, Shimabukuro-Vornhagen A, et al. Overcoming tumor-mediated immunosuppression [J]. Immunotherapy, 2014, 6(9): 973-988.
[11] Collison L W, Workman C J, Kuo T T, et al. The inhibitory cytokine IL-35 contributes to regulatory T-cell function [J]. Nature, 2007, 450(7169): 566.
[12] Sakaguchi S, Wing K, Onishi Y, et al. Regulatory T cells: how do they suppress immune responses? [J]. International immunology, 2009, 21(10): 1105-1111.
[13] Beyer M, Schultze J L. Regulatory T cells in cancer [J]. Blood, 2006, 108(3): 804-811.
[14] Banerjee D K, Dhodapkar M V, Matayeva E, et al. Expansion of FOXP3high regulatory T cells by human dendritic cells (DCs) in vitro and after injection of cytokine-matured DCs in myeloma patients [J]. Blood, 2006, 108(8): 2655-2661.
[15] Frumento G, Piazza T, Di Carlo E, et al. Targeting tumor-related immunosuppression for cancer immunotherapy [J]. Endocrine, Metabolic & Immune Disorders-Drug Targets (Formerly Current Drug Targets-Immune, Endocrine & Metabolic Disorders), 2006, 6(3): 223-237.
[16] El Andaloussi A, Han Y U, Lesniak M S. Prolongation of survival following depletion of CD4+ CD25+ regulatory T cells in mice with experimental brain tumors [J]. Journal of neurosurgery, 2006, 105(3): 430-437.
[17] Kiniwa Y, Miyahara Y, Wang H Y, et al. CD8+ Foxp3+ regulatory T cells mediate immunosuppression in prostate cancer [J]. Clinical Cancer Research, 2007, 13(23): 6947-6958.














