关于甲状腺瘤,这些信息你必须知道!
日期:2019-09-29 11:47:55
甲状腺是内分泌系统的一部分,是一组调节身体功能的激素分泌腺。甲状腺癌发生在甲状腺细胞中,是最常见的内分泌相关癌症,约占全身恶性肿瘤的1%。甲状腺癌在女性中更为常见,在大多数地理区域和人口群体中,女性与男性的比例为3:1[1],是女性中第五常见的癌症。绝大多数甲状腺癌都可通过手术和其他方式治愈。
1. 甲状腺
甲状腺是一个蝴蝶状的腺体,位于颈前、喉下、锁骨上。甲状腺是内分泌系统的一部分,它可通过分泌激素控制心率、血压、体温和新陈代谢。
甲状腺有两种主要的细胞类型:卵泡细胞和C细胞。
卵泡细胞利用血液中的碘来制造甲状腺激素,帮助调节人体的新陈代谢。甲状腺释放的甲状腺激素的数量是由位于大脑底部的脑垂体调节的,脑垂体通过产生一种叫做促甲状腺激素(TSH)的物质来促进甲状腺释放甲状腺激素。
C细胞(也称为滤泡旁细胞)则产生降钙素,该激素帮助控制人体如何使用钙。
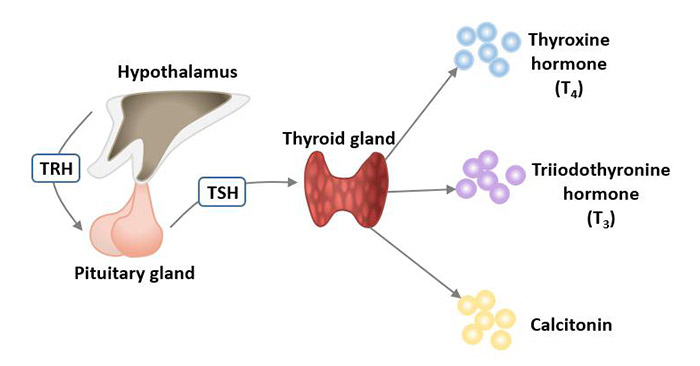
图1 甲状腺分泌的激素
2. 甲状腺瘤的类型
根据起源细胞以及癌细胞分裂速度的不同,可将甲状腺癌分为4种类型:甲状腺乳突癌、滤泡性甲状腺癌、髓甲状腺癌和未分化甲状腺癌。
2.1 甲状腺乳突癌(Papillary Thyroid Cancer)
这是最常见的甲状腺癌类型,70%至80%的甲状腺癌是乳头状甲状腺癌。乳头状细胞类似于手指状突起。虽然它可以发生在任何年龄,但多数在30至60岁。该疾病女性患病的频率是男性的3倍,且通常对老年患者更具攻击性。
乳头状甲状腺癌可能会扩散,一般最常累及颈部淋巴结,较少累及肺部。
如果早期确诊,大多数甲状腺乳突癌患者都可被治愈。
2.2 滤泡性甲状腺癌(Follicular Thyroid Cancer)
在所有甲状腺癌中,滤泡性甲状腺癌所占比例不到15%。该种类型的甲状腺癌多发生于40至60岁的成年人。女性患病的频率高于男性。癌细胞可侵入血管并前往如骨骼或肺组织。
Hürthle细胞是FTC的变种。PTC和FTC以及较不常见的Hürthle细胞癌被归类为分化型甲状腺癌(DTC)[2] [3],起源于滤泡上皮甲状腺细胞。PTC和FTC都进展缓慢,如果早期诊断,通常具有良好的预后。
2.3甲状腺髓样癌(Medullary Thyroid Cancer)
髓甲状腺癌约占所有甲状腺癌的3%[4]。它是由产生降钙素(调节血液中钙和磷酸盐水平,促进骨骼生长)的C细胞或滤泡旁细胞(parafollicular cell)发育而来[5],降钙素水平升高可提示癌症。MTC通常在40到50岁之间确诊,女性和男性同样受到影响。一般认为MTC发病的主要原因是RET原癌基因突变。
根据是否具有遗传性,甲状腺髓样癌包括散发性(非遗传性)和遗传性。遗传性MTC包括MEN2A和MEN2B和家族性甲状腺髓样癌(FMTC)。相比较其他类型的甲状腺癌,甲状腺髓样癌有更明显的家族遗传性。
2.4 未分化甲状腺癌(Anaplastic Thyroid Cancer)
未分化甲状腺癌是比较罕见的甲状腺癌,ATC占所有甲状腺癌的不到2%(女性为77%)。
ATC起源于滤泡细胞,但它不具备其原始的生物学特性[6]。与其他甲状腺肿瘤不同,它的特点是生长和扩散非常快,具侵略性。因此在所有的甲状腺癌中,未分化的甲状腺癌(ATC)是最具侵袭性的甲状腺癌类型[7]。它通常发生于65岁以上的患者,女性比男性更容易受到影响。ATC对常规治疗方法不敏感[8],预后最差,5年生存率为5%[9]。
此外还有甲状腺淋巴瘤。这是一种开始于甲状腺的免疫系统细胞罕见的甲状腺癌,生长非常快,通常发生于老年人。
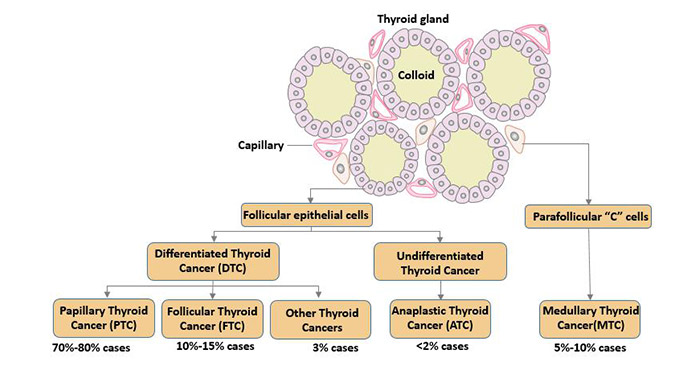
图2 甲状腺癌类型
3. 甲状腺瘤的症状
在发病初期,甲状腺癌通常不表现任何迹象和症状。
随着甲状腺癌的增长,它可能会产生以下症状:
颈部肿块或结节:这是甲状腺癌最常见的症状。甲状腺内发现肿块,质地硬而固定、表面不平。腺体在吞咽时上下移动性小。
声音的变化:持续的沙哑或声音变化,可能会出现经常性与感冒无关的咳嗽。 吞咽或呼吸困难。
颈部淋巴结肿大: 晚期可能因交感神经受压引起Horner综合征及侵犯颈丛而出现耳、枕、肩等处疼痛。
4. 甲状腺瘤的危险因素
已确定的甲状腺癌的危险因素包括电离辐射、家族史、性别、肥胖、饮酒和吸烟。最近的研究也证明了接触阻燃剂和PTC之间的关系[10]。
4.1 性别和种族
甲状腺癌在女性中比男性更常见。白人或亚洲人更容易患甲状腺癌。
4.2 年龄
大多数甲状腺癌的患者年龄在20到55岁之间。
4.3 辐射暴露
暴露在高水平的辐射下可能会增加患甲状腺癌的风险。这主要包括头部和颈部的辐射治疗,以及核电站事故或武器测试等来源的放射性尘降物。
4.4 遗传因素
大多数TC病例是散发性的,仅有5%的DTC表征为家族性(主要是PTC),约25%的MTC作为常染色体性状遗传[11]。
某些遗传基因综合症会增加甲状腺癌风险。这些主要包括家族性髓样甲状腺癌和多发性内分泌肿瘤(2A型和2B型)。多发性内分泌肿瘤(MEN2A和MEN2B)是影响内分泌系统腺体(如甲状腺、甲状旁腺、肾上腺)的肿瘤。
某些基因的突变也是导致甲状腺癌的重要原因。BRAF[12]和RAS家族[4]的突变在甲状腺癌中也经常发生。染色体易位也发生在甲状腺癌中,比如过氧化物酶体增殖物激活受体(PPARγ)易位发生在约30%的滤泡性甲状腺癌病例[13]。
涉及甲状腺癌的关键分子信号通路包括丝裂原激活蛋白激酶(MAPK)通路和PI3K / mTOR通路,p53肿瘤抑制因子等。
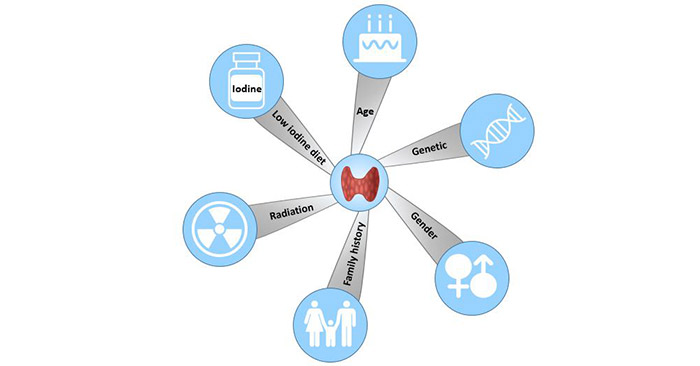
图3甲状腺癌的危险因素
5. 甲状腺瘤的诊断
首先,医生需要首先了解患者的基本情况,是否有甲状腺瘤常见的临床症状。对于甲状腺肿块质硬、固定,颈淋巴结肿大,或有压迫症状者,或存在多年的甲状腺肿块,在短期内迅速增大者,均应怀疑为甲状腺癌。对于有甲状腺髓样癌的家族史的患者,医生会检测你的血降钙素和钙水平。降钙素水平升高可提示癌症。此外,血清降钙素测定可协助诊断髓样癌。
甲状腺瘤的诊断主要方式如下:
5.1 甲状腺扫描
甲状腺扫描用于测试腺体的功能。测试结果报告可能为功能正常、冷(活性不足)或热(活性过度)。对于可疑的冷结节可以通过细针穿刺(针活检)进一步评估。
5.2 超声引导下细针穿刺活检(FNA)
细针抽吸(FNA)是诊断甲状腺癌的一种方法。癌细胞通常看起来与正常细胞不同,因此通过显微镜检查在结节(颈部肿块)或生长中发现的甲状腺细胞来确定甲状腺癌的类型。
5.3 分子检测
许多基因的改变被认为在甲状腺癌形成中起着重要作用。RAS是丝裂原活化蛋白激酶和PI3K-AKT通路的激活因子,滤泡腺瘤中RAS突变的频繁发生提示激活的RAS可能在肿瘤发生的早期发挥作用。针对细针穿刺活检结果不确定的情况,分子检测(基因表达分类)可以来帮助确诊。
6. 甲状腺瘤的治疗
肿瘤的治疗策略需要根据肿瘤的分期来制定。
6.1 肿瘤分期
甲状腺癌分期是医生根据恶性甲状腺肿瘤的特征进行的分类。肿瘤分期可以帮助医生确定甲状腺癌的最佳治疗方案。TNM分期系统,是由美国癌症联合委员会(AJCC)开发的。字母T代表肿瘤,N代表淋巴结,M代表转移。以下表格是运用TNM分期系统对甲状腺癌进行的分期。
表1 甲状腺癌TNM分期系统
| T | N | M |
|---|---|---|
| TX=肿瘤无法评估 | NX=无法评估局部淋巴结 | MX=无法评估远处转移(即扩散) |
| T0=无原发肿瘤 | N0=未扩散至局部淋巴结 | M0=无远处转移 |
| T1=肿瘤大小为2厘米宽或更小 | N1=肿瘤已扩散至局部淋巴结 | M1=远处转移涉及远处淋巴结,内脏器官等 |
| T2=肿瘤大小2- 4cm宽 | N1a=肿瘤已扩散到甲状腺周围的淋巴结 | |
| T3=肿瘤大小大于4 cm或已开始在甲状腺外生长 | N1b=肿瘤已经扩散到颈部或胸部上部的淋巴结 | |
| T4a=肿瘤(任何大小)已广泛生长到甲状腺以外的局部颈部组织 | ||
| T4b=肿瘤已向脊柱或局部大血管生长 |
6.2 治疗方式
6.2.1 手术治疗
手术是治疗除未分化癌以外各型甲状腺癌的基本方法,通常还会应用核素、甲状腺激素及放射外照射等辅助治疗手段。
甲状腺癌的手术治疗包括部分甲状腺切除术或叶切除术和全甲状腺切除术。
部分甲状腺切除术或叶切除术是手术切除部分甲状腺,例如受肿瘤影响的左侧或右侧(lobe)。肺叶切除术一般用于切除小于4厘米的单灶性肿瘤,没有甲状腺外扩张或淋巴结转移的证据。全甲状腺切除术是完全手术切除甲状腺。
6.2.2 内分泌治疗
TSH通过其受体可刺激甲状腺癌细胞的增殖[14]。因此,手术后会使用TSH抑制剂等甲状腺激素治疗。该方法能显著降低不同类型甲状腺癌患者的复发和癌症相关死亡率[15]。
6.2.3 放射性核素治疗
一些甲状腺乳头状或滤泡性癌患者在甲状腺切除术后可能需要接受全身放射性碘(RAI)治疗[16]。放射性碘进入血液后会选择性地破坏剩余的甲状腺组织和癌细胞,不会影响其他任何细胞。该辅助治疗方法适用于45岁以上病人、多发性癌灶、局部侵袭性肿瘤及存在远处转移者。
6.2.4 化疗
化疗是指使用化学制剂(药物)来破坏癌细胞。化疗杀死了癌细胞的同时也杀死了大量正常细胞,因此有很大的副作用。一般来说,甲状腺癌对化疗反应不佳。化疗很少用于治疗甲状腺癌,除非是恶性肿瘤,如未分化型甲状腺癌。
6.2.5 放射外照射治疗
主要用于未分化型甲状腺癌。
6.2.6 靶向治疗
甲状腺癌的常规治疗包括甲状腺切除术、放射性碘化物治疗和甲状腺刺激激素(TSH)抑制治疗。虽然总体预后较好,但仍有一小部分患者存在淋巴结转移、肿瘤复发、耐药等情况。因此,开发新的甲状腺癌的治疗策略是极其重要的。
MAPK通路的突变被认为是启动甲状腺癌的发展,并导致基因表达的改变,该通路可促进细胞增殖,细胞生长,血管生成。PI3K / mTOR通路,p53肿瘤抑制因子的改变被认为会促进肿瘤的进展。在甲状腺癌中,通过阻断MAPK通路来发挥抗肿瘤作用已得到广泛应用。
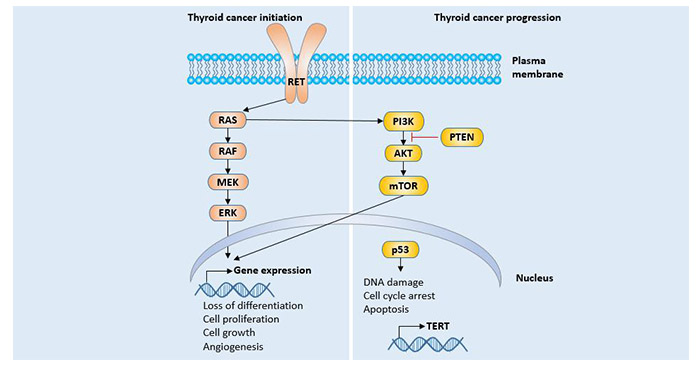
图4 甲状腺癌相关通路
FDA已经批准了四种针对丝裂原激活蛋白激酶(MAPK)信号通路治疗晚期甲状腺癌的不同药物[17][18]。其中,Lenvatinib和索拉非尼主要用于晚期、复发性和耐药DTC的治疗,Cabozantinib和Vandetanib针对MTC。
此外,BRAF突变在甲状腺癌的进展中起着重要作用,而且在所有基因突变中占29-83%[19]。一类被称为激酶抑制剂的靶向药物可能有助于治疗某些基因突变的甲状腺癌细胞,如BRAF和RET/PTC。针对BRAF基因改变细胞的药物,如vemurafenib (Zelboraf)、dabrafenib (Tafinlar)和selumetinib。其他激酶抑制剂在临床试验中显示出早期治疗甲状腺癌的希望,包括舒尼替尼(Sutent)、帕佐帕尼(Votrient)和阿西替尼(Inlyta)。阿西替尼、舒尼替尼和索拉非尼,具有抗血管生成的特性,可通过破坏肿瘤新生血管的形成来抑制肿瘤的生长。
Reference:
[1] Kilfoy B, Zheng T, Holford T, et al. International patterns and trends in thyroid cancer incidence, 1973-2002 [J]. CANCER CAUSES & CONTROL, 2009, 20(5): 525-531.
[2] Arribas J, Castellvi J, Marcos R, et al. Expression of YY1 in Differentiated Thyroid Cancer [J]. Endocrine Pathology, 2015, 26(2): 111-118.
[3] Nagy R, Ringel M D. Genetic Predisposition for Nonmedullary Thyroid Cancer [J]. Hormones and Cancer, 2015, 6(1): 13-20.
[4] Nikiforov Y E, Nikiforova M N. Molecular genetics and diagnosis of thyroid cancer [J]. NATURE REVIEWS ENDOCRINOLOGY, 2011, 7(10): 569-580.
[5] Carneiro R M, Carneiro B A, Agulnik M, et al. Targeted therapies in advanced differentiated thyroid cancer [J]. Cancer Treatment Reviews, 2015, 41(8): S0305737215001243.
[6] Chiacchio S, Lorenzoni A, Boni G, et al. Anaplastic thyroid cancer: Prevalence, diagnosis and treatment [J]. Minerva endocrinologica, 2009, 33(4): 341-357.
[7] Xu B, Ghossein R. Genomic Landscape of poorly Differentiated and Anaplastic Thyroid Carcinoma [J]. Endocrine Pathology, 2016, 27(3): 205-212.
[8] Chiappetta G, Valentino T, Vitiello M, et al. PATZ1 acts as a tumor suppressor in thyroid cancer via targeting p53-dependent genes involved in EMT and cell migration [J]. Oncotarget, 2014, 6(7): 5310-23.
[9] Hoang J K, Nguyen X V, Davies L. Overdiagnosis of Thyroid Cancer: Answers to Five Key Questions [J]. Academic Radiology, 2015, 22(8): 1024-1029.
[10] Hoffman K, Lorenzo A, Butt C M, et al. Exposure to flame retardant chemicals and occurrence and severity of papillary thyroid cancer: A case-control study [J]. Environment International, 2017, 107: 235-242.
[11] Lodish M B, Stratakis C A. RET oncogene in MEN2, MEN2B, MTC and other forms of thyroid cancer [J]. Expert Review of Anticancer Therapy, 2008, 8(4): 625-632.
[12] None. Integrated Genomic Characterization of Papillary Thyroid Carcinoma [J]. Cell, 2014, 159(3): 676-690.
[13] Raman P, Koenig R J. Pax-8–PPAR-γ fusion protein in thyroid carcinoma [J]. Nature Reviews Endocrinology, 2014, 10(10): 616-623.
[14] Biondi B, Filetti S, Schlumberger M. Thyroid-hormone therapy and thyroid cancer: a reassessment [J]. Nature Clinical Practice Endocrinology & Metabolism, 2005, 1(1): 32-40.
[15] Mazzaferri E L. Current Approaches to Primary Therapy for Papillary and Follicular Thyroid Cancer [J]. Journal of Clinical Endocrinology & Metabolism, 2001, 86(4): 1447-1463.
[16] Spitzweg C, Bible K C, Hofbauer L C, et al. Advanced radioiodine-refractory differentiated thyroid cancer: the sodium iodide symporter and other emerging therapeutic targets [J]. The Lancet Diabetes & Endocrinology, 2014, 2(10): 830-842.
[17] Cooper D S, Doherty G M, Haugen B R, et al. Revised American Thyroid Association management guidelines for patients with thyroid nodules and differentiated thyroid cancer [J] .Thyroid, 2009, 19: 1167-214.
[18] Haugen Bryan R, Alexander Erik K, Bible Keith C, et al. 2015 American Thyroid Association Management Guidelines for Adult Patients with Thyroid Nodules and Differentiated Thyroid Cancer: The American Thyroid Association Guidelines Task Force on Thyroid Nodules and Differentiated Thyroid Cancer [J] .Thyroid, 2016, 26: 1-133.
[19] Xing M. BRAF mutation in thyroid cancer[J]. Endocrine Related Cancer, 2005, 12(2): 245-262.
上一篇: 肿瘤标志物CD146














