科研就像赛跑,你比别人跑的快,就比别人多发几篇SCI~
上一期,给朋友们带来了
咱们书接上回,继续干货奉上~
蛋白免疫印迹(WB)是基于抗原抗体的特异性结合作用,以检测复杂样品中的某种蛋白,并对其进行半定量分析的一种方法。
主要用于靶标蛋白特异性表达的定性或半定量分析,蛋白与蛋白或蛋白与DNA相互作用的后续分析,以及蛋白修饰的鉴定分析。
4.1 SDS-PAGE凝胶
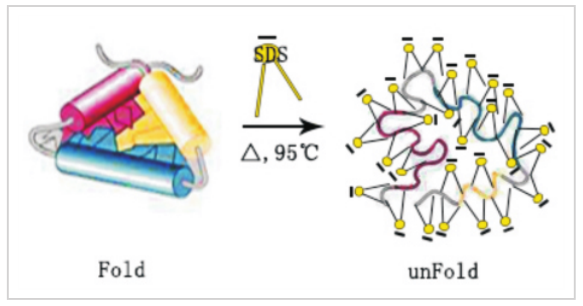
利用丙烯酰胺和甲叉双丙烯酰胺的聚合作用,可以形成一种网状的凝胶结构,具有一定的分子筛作用。蛋白在大量SDS胶束包裹下,形成SDS的电荷效应,蛋白分子本身电荷被覆盖,蛋白在电势作用下,只与所包裹的SDS所带负电荷相关,即反映分子量大小。SDS-PAGE的分辨率与所使用交联剂丙烯酰胺和甲叉双丙烯酰胺的浓度相关。不同浓度的交联剂所形成的网状分子筛孔径不同,形成分子筛效应。分离情况如下:
|
分离胶浓度
|
分离范围(kDa)
|
|
8%
|
70-200
|
|
10%
|
25-70
|
|
12%
|
20-55
|
|
15%
|
15-45
|
✪ 丙烯酰胺凝胶的成分及作用
4.2 电泳液的配制与选择
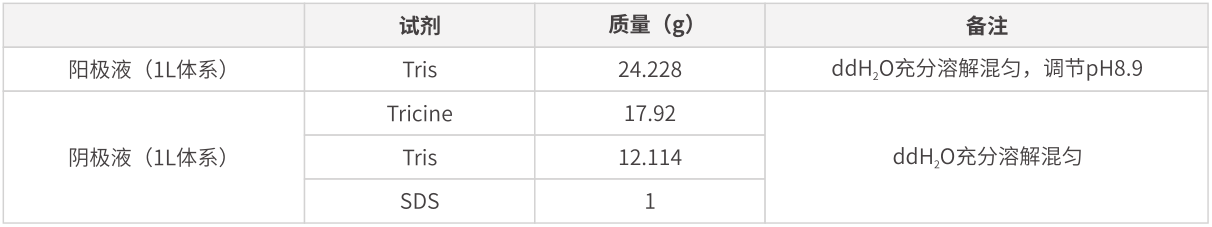
常规SDS-PAGE凝胶电泳对于分离30-250 kDa范围内的蛋白具有较好的分离作用,根据蛋白分子量大小的不同,参照分离情况表选择合适的分离胶浓度。1L电泳液配方如下:
使用Glycine-Tris-gel电泳体系时,一般电泳条件为恒压,浓缩胶60-80 V,分离胶100-120 V。电压越小,跑的越慢,分离效果更好。
但对于分子量低于30 kDa的小分子蛋白,Glycine-Tris-gel体系分辨率不高,无法达到相应的分离效果。Tricine相对于Glycine具有更好的电子迁移率和解离常数,使得小分子蛋白在浓缩胶内具有更好的浓缩效应,且在分离胶内具有更高的分辨率。所以,对于小分子蛋白推荐使用电泳液配方如下:
使用Tricine-Tris-gel电泳体系时,一般条件为恒压,电压不宜过大,60-100V左右。
4.3 Protein Marker 与内参选择
在实验过程中,根据实验需求需要设置相应对照。
◎ 分子量指示剂
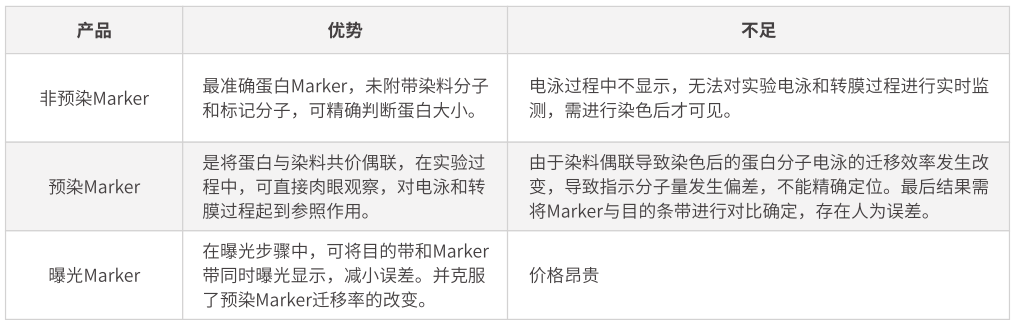
合适范围的蛋白Marker,可指示蛋白分子量大小,并在一定程度上反映电泳效果和转膜效率。按照不同使用特性,目前所使用的Marker大致可以分为3种:普通非预染Marker、预染Marker、曝光Marker。
◎ 阳性对照
组织或细胞中已证实有相应蛋白表达的样本即阳性对照品。
◎ 内参对照
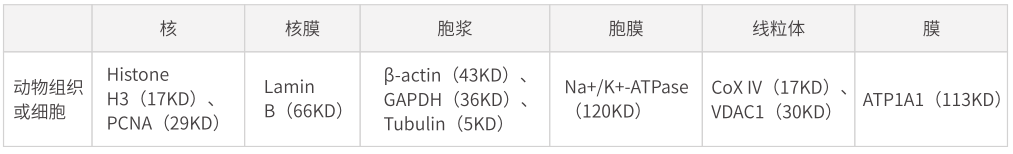
由于管家基因编码表达的蛋白在各种组织和细胞中的表达量相对恒定,故而在对蛋白进行定量检测时,需要将此类蛋白作为内参,以校正蛋白定量和上样的误差。另外,内参蛋白还可以用于监测整套实验体系是否成功。
由于研究对象的不同,需要根据实验目的对内参蛋白进行选择:
此外,在选择内参蛋白时还应注意以下几点:
1. 注意某些特定条件下的内参基因表达可能发生变化,而不适于作为内参对照。比如药物诱导或者外界刺激存在时,导致某些管家基因的表达量不再恒定,而是发生一定变化。需要结合具体的实验方案,并查询相关文献综合考虑。
2. 目的蛋白与内参蛋白大小应存在差异,便于检测操作和区分。如果选用的内参蛋白大小与目的蛋白大小相差不大时,可以先进行目的蛋白的显影。随后采用一抗二抗去除液洗去目的抗体,再进行内参抗体的孵育与显影。
◎ 转膜方式膜介质的选择
将电泳分离后的蛋白从凝胶中转移到固相介质上,通常采用湿转和半干转。两种方法原理相同,只是施加电场的机械装置和用于固定胶与膜的方式有所不同,半干转用浸润缓冲液buffer的多层滤纸替代。两种方法比较如下:
在转膜时,高电流作用下,短时间内装置产热非常明显,所以转膜过程应采取相关措施,以保持低温环境。湿转时,可以将装置进行冰浴,有利于散热。半干转时,不宜长时间进行电转,所以推荐大分子蛋白(100 kDa以上)采用湿转。对于小分子蛋白和正常分子蛋白,湿转与半干转效率相差不大。对于高丰度,小块胶,建议干转,提高效率。低丰度,大块胶,建议湿转。
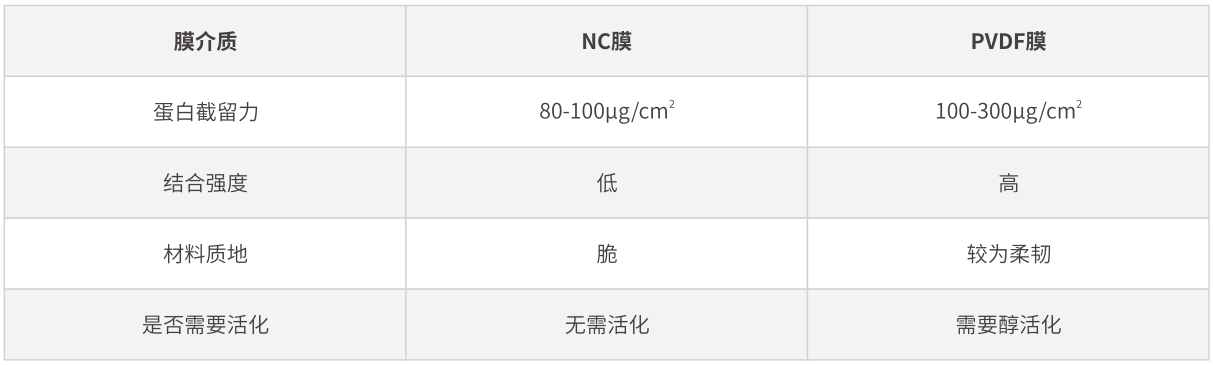
◎ 膜介质的选择
转膜过程中使用的膜介质,目前使用最多的包括两种,即硝酸纤维素膜(NC膜)和PVDF膜。
NC膜的结合能力主要是与其纯度相关,纯度越高,与蛋白结合能力更强。但纯度高的NC膜较脆,容易出现破碎的情况。相对于NC膜,PVDF膜具有更强的蛋白结合能力,且其具有更好的化学耐受性。
需要注意的是,PVDF膜使用前,需在甲醇中浸泡(>15 s)以活化膜上的正电基团,并在转膜液中平衡一段时间。另外,PVDF膜与NC膜都具有不同孔径大小。对于小分子蛋白(<20 kDa),建议使用0.22 μm孔径的膜,避免出现转过的现象。正常情况下使用0.45 μm孔径的膜即可。
◎ 蛋白分离与转膜条件优化
对于小分子蛋白的转膜,可从以下几点进行优化:
1. 可以增大交联剂浓度,采用15%丙烯酰胺凝胶进行电泳。但对于15 Kda以下的蛋白,此胶的分辨率较低,建议在浓缩胶和分离
胶之间增加10%的间层胶,以增加小分子蛋白分辨率。
2. 采用Tris-Tricine电泳体系替代Tris-Glycine缓冲体系,达到更好的浓缩作用与分离效果。注意应用该系统时,电压不宜过大,60-80 V为宜。
3. 选取0.22 μm孔径的膜介质
4. 缩短转膜时间,可采用干转方式进行转膜。
对于大分子蛋白的转膜,可从以下几点进行优化:
1. 降低交联剂浓度,采用8%-5%丙烯酰胺凝胶进行电泳,但需注意胶浓度越低,越容易破碎,操作时应小心。
2. 转膜时,电流适当调大,转膜时间延长,并避免转膜过程中出现高热,推荐湿转4℃过夜。
3. 适当降低转膜缓冲液中的甲醇,可促进胶中SDS分子与蛋白的分离,高浓度的甲醇对蛋白有固定作用,而不利于大分子蛋白泳出,可降低甲醇浓度至10%。
◎ 转膜效率监测
1. 预染Marker的转膜情况在一定程度上反映了蛋白转移效率。
2. 对胶进行丽春红染色,根据染色后的条带查看是否转膜成功。此过程为可逆过程,但不适用于尼龙膜的染色。
丽春红染色液的配制:5%(V/V)乙酸,0.1%(W/V)丽春红,ddH2O混匀,置于4℃保存。
丽春红染色流程如下:将转膜后的PVDF膜或NC膜浸没在丽春红染色液中5-10min振荡。取出印迹膜,用PBS洗涤3×5 min。观察染色的红色条带,记录转膜情况。再次使用PBS洗涤3×5 min,以去除结合的丽春红,便于后续WB检测。
3. 对胶进行考马斯亮蓝染色,此染色过程不可逆,但考马斯亮蓝染色灵敏度较丽春红高。
考马斯亮蓝染色液的配制:10%(V/V)冰醋酸,45%(V/V)甲醇,0.25%(W/V),ddH2O混匀。
考马斯亮蓝脱色液的配制:25%(V/V)甲醇,8%(V/V)冰醋酸,ddH2O混匀。
考马斯亮蓝染色流程如下:将转膜后的PVDF膜或NC膜浸没在考马斯亮蓝染色液中,置于水平摇床上缓慢摇动,室温染色1 h(根据胶大小、厚度和温度调整),至胶染成蓝色。倒出染色液,将胶浸入脱色液中,置于水平摇床上缓慢摇动,室温脱色4 h,至蓝色背景脱去,蛋白条带可见。
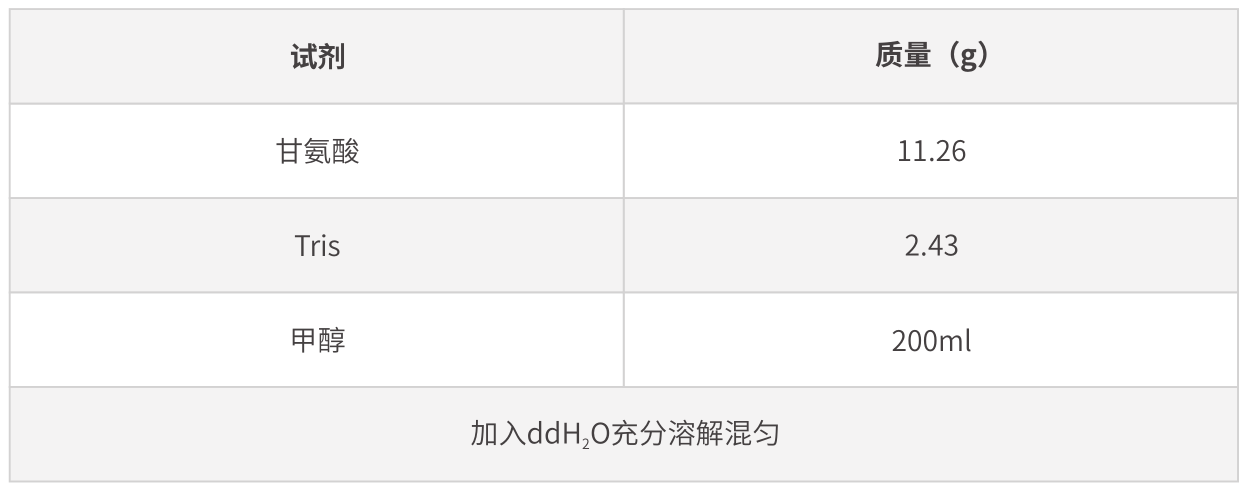
◎ 转膜缓冲液的配制
1L转膜缓冲液配制如下:
转膜buffer需避光保存,可重复使用多次,但由于甲醇较易挥发,应及时更换使用新鲜转膜缓冲液。
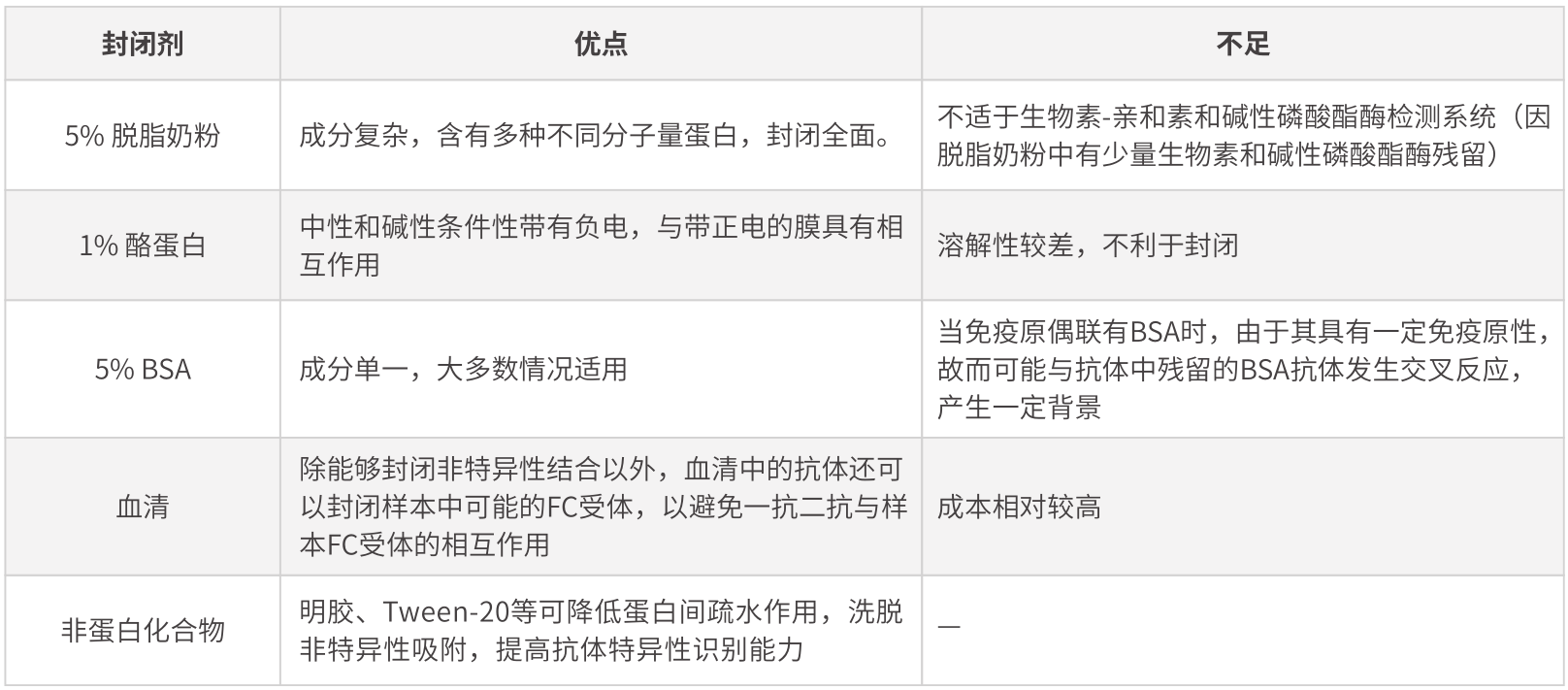
◎ 封闭剂的选择
固相介质表面材质不均一,有很多细小孔洞。当蛋白被转移至固相介质以后,通过非共价作用力吸附于固相介质表面。但并不是所有位点都吸附了蛋白,故需要将封闭剂吸附到固相介质上,以避免抗体分子直接吸附到膜上,产生假阳性或者高背景的结果。
选择封闭剂的原则是封闭剂应能够封闭膜上所有未结合位点,而不干扰目的蛋白的结合,且不与靶蛋白表位进行结合,不与抗体及其他试剂有交叉反应。
常用封闭剂如下:
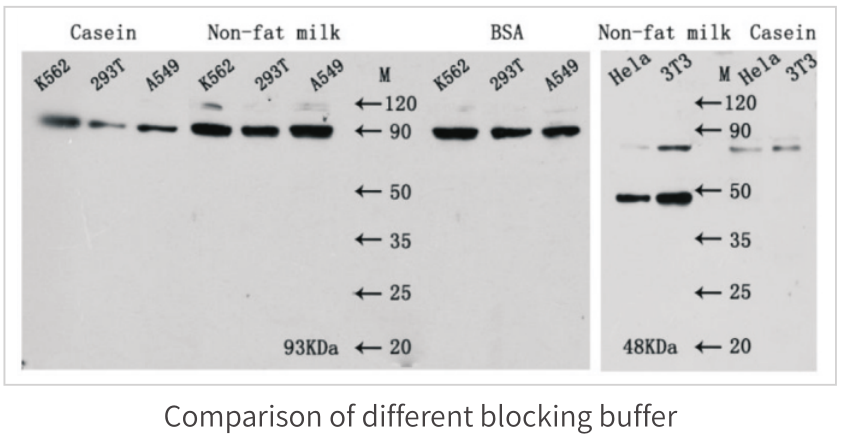
不同封闭剂的比较实验如下:
需要特别注意的是,对于磷酸化的蛋白,进行检测时不建议使用脱脂奶粉和酪蛋白作为封闭剂,并使用TBST替代PBST。对于封闭剂的选择需要根据结果情况进行相应调整,对于大部分抗体在用脱脂奶粉时,可以达到好的封闭效果,但有些抗体在使用BSA封闭时,能够更好的降低背景。封闭条件一般为室温振荡封闭1h。
按照产品说明,对一抗进行适当稀释,一抗稀释液一般与封闭剂组分相同。另外,建议
选择已有验证的一抗。另外,一抗建议4℃孵育过夜,使抗原抗体充分结合。
对于一抗稀释比例最好做梯度预实验,以确定最佳稀释比例。此时可采用简单的Dot blot法进行摸索。使用NC膜,在膜上依次点上不同上样量的样本,自然风干。待膜完全吸收样本后,进行封闭。随后,按上样梯度对膜进行裁剪,分别采用不同浓度梯度的一抗孵育,相同二抗孵育。最后ECL发光底物孵育显影。观察显影情况进行抗体稀释比范围的初步判定。
◎ 实验操作
1. 二抗孵育前,用PBST/TBST洗膜3×10 min,以去除未结合的一抗。
2. 对二抗进行适当稀释,室温孵育1h。
3. 二抗孵育完成后,用PBST/TBST洗膜3×10 min,以去除未结合的二抗,再进行后续实验。
◎ 二抗选择
1. 物种来源
不建议选择来源于鼠或兔来源的二抗,因其与人的同源性较大,容易发生交叉反应,导致高背景。常使用羊或驴来源二抗,所使用二抗必须与一抗种属来源不同,且需根据一抗种属选择抗该种属的二抗。另外,还应注意所使用单克隆一抗的亚型,选择针对一抗亚型的二抗。
2. 纯化方式
对于目前抗体纯化方式主要有Protein G/A纯化和抗原亲和纯化。前者可与血清中所有抗体IgG分子发生结合,抗原特异性无区分。后者是通过能够与抗体特异性识别的配体或者受体来进行结合洗脱,可以纯化血清中的特异性抗体成分。所以,亲和纯化二抗可大大减少非特异性结合,提高蛋白的检测特异性。
3. 合适的标记物
WB中最常使用二抗标记物为酶标二抗,如辣根过氧化物酶HRP和碱性磷酸酯酶AP。HRP特异性强,作用底物较为广泛,经济快速,且稳定。AP虽然更为灵敏,但其背景往往更高,且在实验样本中可能存在的内源性磷酸酯酶会干扰实验结果。另外,使用AP标记二抗时,封闭剂也应谨慎选择,避免磷酸酯酶的干扰。
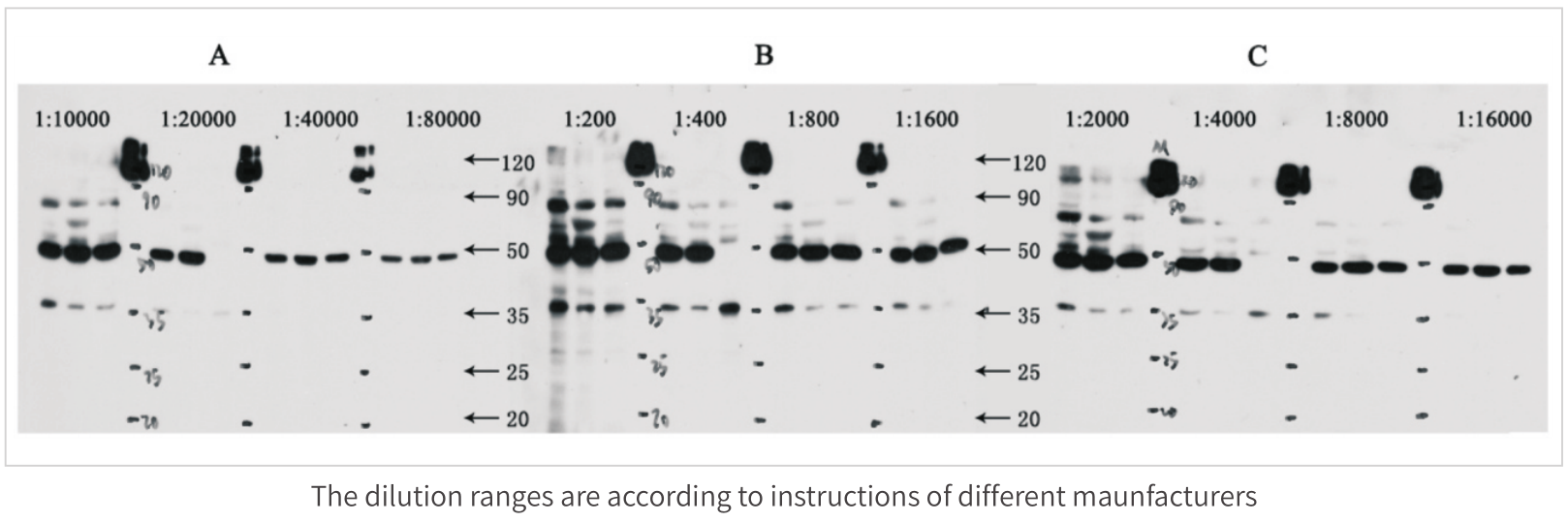
不同厂家二抗(HRP标记)的比较实验如下:
1. 化学发光显色
最为经典的HRP化学发光底物Luminol,在H2O 存在下,与辣根过氧化物酶发生酶促反应,发出荧光,灵敏度高,成像性好,可在胶片上进行显影。
2. 底物显色
HRP的生色底物有多种,其中最常用的是DAB,其通过与HRR反应生成不溶性棕褐色沉淀而显色,其灵敏度高,但需要现配现
用,且具有致癌性,操作时应小心操作。
3. 荧光显色
通过使用合适的荧光二抗,可实现荧光二抗显影,弥补了化学发光和底物显色的定量缺陷。
实验流程基本就到这了
~下期常见问题解答专属奉上哟~
1.蛋白样品准备
2.蛋白定量
3.上样
4.凝胶电泳
5.转膜
6.封闭
7.孵育一抗
8.孵育二抗
9.显影
10.常见问题
—未完·待续—
——j9九游会登录入口首页生物·让科研变得有温度!——
扫码关注官方微信,后台回复【实验技术WB】
免费下载实验手册,精彩内容抢先掌握!