实验技术|蛋白免疫印迹WB(上)
日期:2019-03-13 11:19:12

Western Blot
对于任何一个科研菌都不陌生。
BUT
为甚么别人的实验,时间短跑胶快?
除了实验精细化操作,
当然也离不开选择最佳的试剂,
和对关键实验步骤的优化设计。
科研就像赛跑,你比别人跑的快,就比别人多发几篇SCI~
阳春三月,咱们从WB说起……
蛋白免疫印迹(WB)是基于抗原抗体的特异性结合作用,以检测复杂样品中的某种蛋白,并对其进行半定量分析的一种方法。
主要用于靶标蛋白特异性表达的定性或半定量分析,蛋白与蛋白或蛋白与DNA相互作用的后续分析,以及蛋白修饰的鉴定分析。

1.1 蛋白样品来源
用于WB的蛋白样本可以是可溶性蛋白液,细胞组织裂解液,及免疫沉淀蛋白。对于不同样品蛋白上样量存在区别,纯蛋白建议不超过100 ng,细胞组织裂解液10-40 μg。
1.2 蛋白样品制备
一般从动植物组织或细胞中提取复杂蛋白成分,在提取过程中应遵守如下原则:
① 结合蛋白特性采用合适的提取方法;
② 采用合适的方法最大限度提取靶标蛋白;
③ 保持低温操作,并加入蛋白酶抑制剂,防止蛋白降解;
④ 选择合适的蛋白裂解液,以维持蛋白可溶性状态;
⑤ 蛋白样品-80℃低温保存或变性后保存,避免反复冻融,并尽快检测。
✪ 细胞样本蛋白制备
➥待细胞汇合度达到80%,取出培养皿(10 cm),此时细胞生长至对数期,活性良好。弃去培养液,加入预冷的PBS缓冲液洗涤3次,置于冰上。
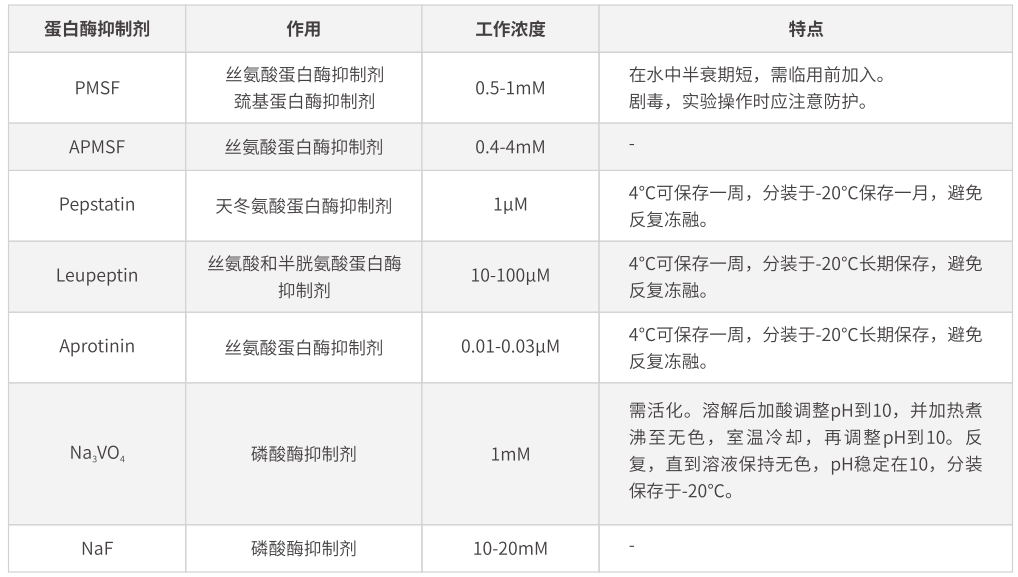
➥配制含蛋白酶抑制剂的裂解液,常用蛋白酶抑制剂见下表,需根据实验要求选择合适的蛋白酶抑制剂。最常用的蛋白酶抑制剂为PMSF(工作浓度1 mM),剧毒,使用时应注意自我防护,其在水中半衰期极短,故在临用前加入。
➥加入1 mL含蛋白酶抑制剂的蛋白裂解液于10 cm培养皿中,轻轻晃匀后,置于冰上裂解15-30 min。
➥用干净的细胞刮迅速刮取细胞于一侧,并将含细胞碎片的裂解液转移至1.5 mLEp管中,置于冰上。此时应避免气泡产生。
注:收集的细胞亦可通过超声破碎进行充分裂解。将超声探头置于样本裂解液中部,但不触碰管壁或管底,进行超声。
➥于4℃,12000 rpm离心10-15 min。
➥轻轻取出EP管,用枪头吸去上层上清于新的EP管中,注意不要吸到上层漂浮的脂质等杂质,并置于冰上备用。
➥经蛋白定量后,加入适量6×Sample loading buffer 95℃煮样5 min,12000 rpm离心30 s,-20℃保存。
✪ 组织样本蛋白制备
➥获取新鲜组织样本,并用生理盐水或PBS洗涤干净,用洁净的剪刀将组织剪碎至合适大小。可采用1-2 mL匀浆器置于冰上进行组织匀浆,或加入液氮进行研磨。因组织块相对不易破坏,且在匀浆过程中存在摩擦产热,推荐采用液氮研磨。
➥配制含蛋白酶抑制剂的裂解液。
➥加入适量含蛋白酶抑制剂的裂解液(50 mg/500 μL)于研磨后的组织样本中,将离心管置于冰上裂解15-30 min,期间进行间断混匀,以充分裂解。
注:为确保组织细胞充分裂解,建议进行超声破碎。调节超声仪至适宜频率与功率(超声功率不宜过大,并设置超声间歇,以防止超声探头过度产热),将超声探头置于样本裂解液中部,但不触碰管壁或管底,进行冰浴超声。
➥于4℃,12000 rpm离心10-15 min。
➥轻轻取出EP管,用枪头吸去上层上清于新的EP管中,注意不要吸到上层漂浮的脂质等杂质,并置于冰上备用。
➥经蛋白定量后,加入适量的6×Sample loading buffer 95℃煮样,12000 rpm离心30 s,-20℃保存。

1.3 蛋白裂解液的选择
蛋白裂解液的主要成分及其作用如下:
1. 缓冲体系
一定pH范围的缓冲体系,为蛋白提供了一个稳定环境,并增加蛋白溶解度。常用近似生理pH状态的Tris-HCl或HEPES缓冲体系,pH7.4。Tris-HCl(pKa=8.1)pH缓冲范围为7.0-9.2,其对温度较为敏感。HEPES(pKa=7.55)pH缓冲范围为6.5-8.5。
2. 盐离子
在适当盐离子浓度下,保持蛋白溶解状态。选择近似生理状态下的150 mM的NaCl,不会对破坏蛋白以及蛋白间相互作用产生影响。
3. 螯合剂
螯合金属离子,以防止蛋白提取物过于黏稠,导致溶解度下降。另外,螯合剂亦可与某些酶发生相互作用,以抑制酶活性。
4. 还原剂
加入一定量的还原剂保护蛋白质上自由的巯基不被氧化,从而避免蛋白质的聚集或变性。常用β-巯基乙醇或二硫苏糖醇(DTT),后者还原能力强于前者。β-巯基乙醇具有挥发性,加入缓冲液中以后较短时间内会被氧化,会对蛋白活性产生影响,其使用浓度为5-20 mM/L。而DTT具有更强的还原能力,且在氧化以后能够形成稳定的分子内二硫键,不会影响蛋白巯基,使用浓度相对偏低为0.5-1 mM/L。长期保存建议使用DTT,但DTT溶液不稳定,需要现配现用。
5. 去垢剂
去垢剂即表面活性剂,其通过分子结构特征,表面活性剂分子的疏水段插入膜的磷脂双分子层,而改变其通透性,最终破坏膜结构。因此,表面活性剂的强度直接决定了裂解细胞的强度。裂解液中所使用的表面活性剂主要可分为两大类:阴离子型表面活性剂和非离子型表面活性剂。常用表面活性剂如下:
十二烷基硫酸钠(SDS):阴离子表面活性剂,具有很强的破坏力,基本可以使所有的蛋白溶解,并破坏其天然构象结构。SDS与蛋白分子以1.4:1的比例进行结合,可以有效的覆盖蛋白本身所带的电荷情况。SDS的临界胶束温度较高,在低温时即会发生沉淀,且在钾盐存在时,沉淀效果会更明显。另外溶液离子强度越强,会降低离子型去污剂的临界胶束浓度,使得这种蛋白溶解效果更强。
脱氧胆酸钠(NaDOC):也是一种离子型表面活性剂,作用较SDS弱。
Triton X-100:是一种非离子型表面活性剂。可以破坏蛋白质与脂质间的相互作用,但并不使蛋白变性,也不破坏蛋白与蛋白间的连接,能够保留蛋白质的天然构象。其具有较低的临界胶束浓度,在64℃下,可观察到两相分离。
NP-40:非离子型表面活性剂,对核膜的破坏作用较弱,与蛋白结合力强,可确保蛋白的充分溶解和结构稳定,特别适用于膜蛋白非变形条件下的溶解。
Tween 20:温和非离子型表面活性剂,蛋白溶解能力较弱,也不会破坏蛋白结构,并不作为蛋白裂解液的常见成分。
去污剂的选择取决于所要提取蛋白的性质与实验目的。需要充分裂解细胞,并溶解蛋白,对于提取后蛋白的状态(变性还是保留天然状态)都是需要考虑的问题。
6. 蛋白酶抑制剂
由于在蛋白提取过程中,细胞和组织被破坏,大量蛋白酶被释放。除了保持在低温条件下操作以抑制蛋白酶活性外,还应加入适量蛋白酶抑制剂以抑制蛋白酶的活性,防止目的蛋白的降解。常用蛋白酶抑制剂如下表:
为了对样品中的目的蛋白进行相对定量,需要对样品间的总蛋白量进行检测。在总蛋白含量一定的情况下,体现目的蛋白的表达差异。常用化学定量方法如下:
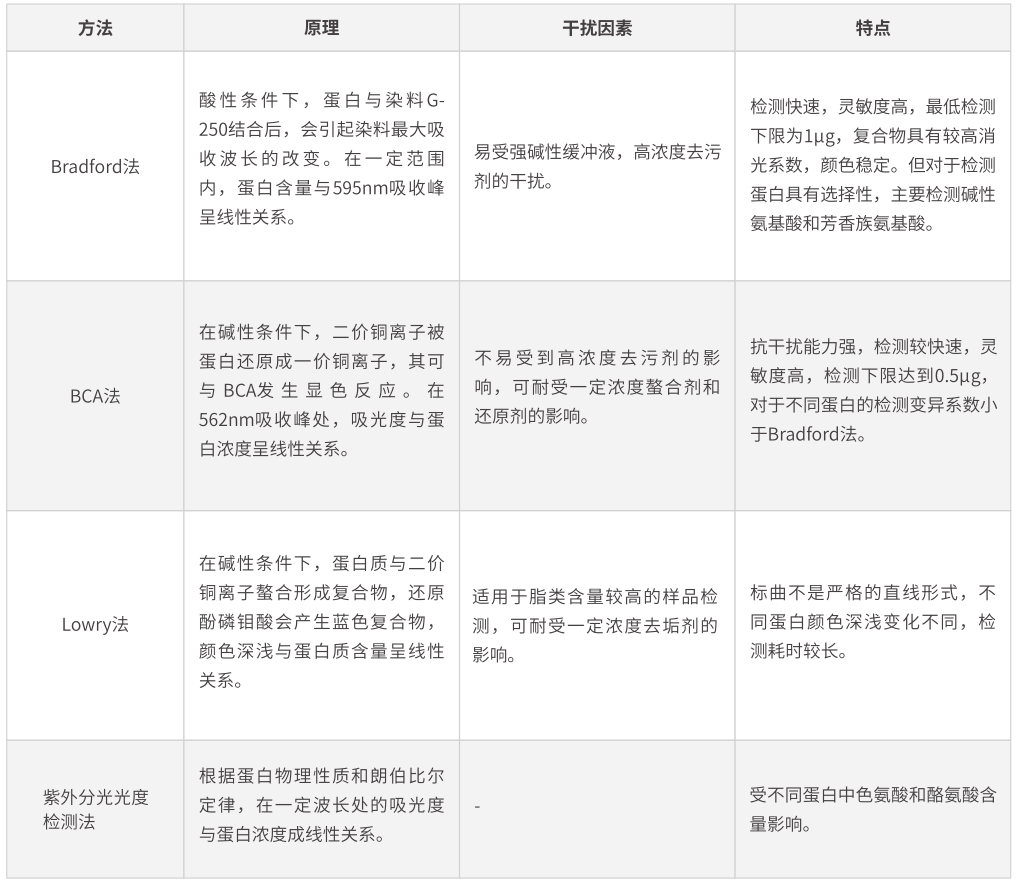
最常使用的蛋白定量方法是BCA法和Bradford法。但当所使用裂解液中含有高浓度去垢剂时,推荐使用BCA法定量蛋白。
2.1 Bradford法标准曲线的绘制
1.标准蛋白质溶液配制:
10 mg/mL牛血清白蛋白(BSA)标准品。准确称取0.05 g牛血清白蛋白,溶于5 mL PBS中,即为10 mg/mL牛血清白蛋白。
2.考马斯亮蓝G-250染色液配制:
称取50 mg考马斯亮蓝G-250,溶于25 mL 90%乙醇中,加入85%的磷酸50 mL,最后用纯水定容到500 mL,考马斯亮蓝染色液需避光保存。
3.稀释待测蛋白:
将蛋白稀释三种不同梯度的浓度10倍,20倍,40倍。
4.稀释标曲:
将标准品稀释8种不同浓度梯度:
| 浓度梯度 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 浓度(mg/mL) | 0 | 0.05 | 0.075 | 0.1 | 0.15 | 0.2 | 0.3 | 0.4 |
5.将稀释好的标曲和样品各取20 μL按顺序依次加入到酶标孔条中,然后再依次加入G250染色液180 μL,混匀。
6.在酶标仪595 nm处测定吸光值,根据吸光值做出标准曲线,并根据标准曲线计算蛋白浓度。
2.2 BCA检测法
1.根据蛋白数量,按50:1(V/V)的BCA试剂A与B配置BCA工作液,室温24 h内稳定;
2.溶解标准品,使终浓度为0.5 mg/mL。所用溶剂与样品所用溶剂相同;
3.将标准品按照0,1,2,4,8,12,16,20 μL体积加入到酶标板中,并加标准品稀释液补足到20 μL;
4.向个孔中加入200 μL BCA工作液,于37℃放置30 min;
5.酶标仪检测562 nm处吸光度值;
6.根据绘制的标准曲线计算出样品蛋白浓度。
3.1 蛋白样品制备
变性蛋白,破坏蛋白三级结构,暴露抗原表位,便于抗体结合与后续检测。将定量后的蛋白加入等体积2×Sample loading buffer 或1/5体积6×Sample loading buffer,于95℃加热煮沸5 min。
对于膜蛋白,由于高温会使得其聚集沉淀,在37℃处理30 min即可。
6×Sample loading buffer 配方如下:
6%Tris(pH6.8)(V/V)
4%SDS(W/V)
0.2%溴汾蓝(W/V)
20%甘油(V/V)
9%DTT(V/V)
● 注意事项:
蛋白溶液上样量以10-40 μg/孔为宜,避免上样量超载,造成拖尾。
本期给大家带来WB前三节的介绍
~下期干货继续噢~
1.蛋白样品准备
2.蛋白定量
3.上样
4.凝胶电泳
5.转膜
6.封闭
7.孵育一抗
8.孵育二抗
9.显影
10.常见问题
—未完·待续—
——j9九游会登录入口首页生物·让科研变得有温度!——

扫码关注“武汉j9九游会登录入口首页生物”官方微信
后台回复【实验技术WB】
免费下载实验手册,精彩内容抢先掌握!











