淋巴细胞的表面标志物
日期:2023-11-28 09:24:15
淋巴细胞是最小的白细胞,是淋巴器官产生的一种免疫识别细胞系。根据它们的迁移、表面标志物和生物功能,淋巴细胞可以分为三类:T淋巴细胞(T细胞)、B淋巴细胞(B细胞)和自然杀伤细胞(NK细胞)。这三个亚群在免疫中发挥不同的作用:T淋巴细胞引发细胞介导的免疫,B淋巴细胞主要负责体液免疫,NK细胞介导先天免疫。
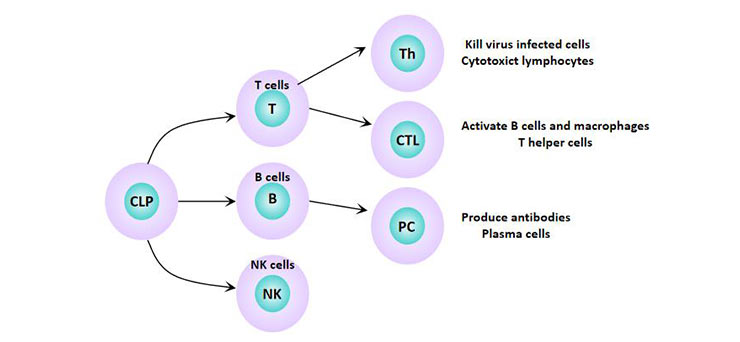
图1. 淋巴细胞亚群
1. 为什么要鉴定不同的淋巴细胞亚群?
淋巴细胞亚群的平衡维持着机体正常的免疫功能。淋巴细胞亚群数量和功能的异常变化会导致一系列病理变化和免疫功能紊乱,从而导致疾病的发生。研究表明,淋巴细胞亚群在肿瘤形成 [1] [2]、传染病 [3] [4]、器官移植 [5] [6]、自身免疫性疾病、糖尿病等过程中起着重要作用。因此,临床上淋巴细胞亚群的鉴定和监测具有重要意义。
2. 如何鉴定不同的淋巴细胞亚群?
三种类型的淋巴细胞在形态上基本相似,需要通过表面标志物检测来区分不同的亚群。淋巴细胞表面标志物根据淋巴细胞类型和分化阶段而异。
3. 什么是细胞表面标志物?
细胞表面标志物是嵌入在细胞膜脂双层结构中的膜蛋白,通常包括膜抗原、膜受体和其他分子。淋巴细胞与周围环境中的其他细胞和分子之间的相互作用,以及在抗原中淋巴细胞的生物效应,包括识别、激活、辅助、抑制和杀伤,都与它们的表面标志物有关。利用细胞表面标志物来区分T淋巴细胞和B淋巴细胞极大地推动了免疫现象的细胞基础分析 [7]。
淋巴细胞表面标志物的检测在基础和临床免疫学研究以及患者免疫功能测定中得到广泛应用。淋巴细胞表面标志物通常分为三大类:表面免疫球蛋白(SIg)、分化抗原(或特异性抗原)和膜受体。CD(分化簇)分子是最常用的细胞表面标志物之一。
4. T淋巴细胞及其细胞表面标志物
4.1 T淋巴细胞
T细胞是特异性抗原的淋巴细胞,源自造血组织并在胸腺中成熟。它们得名于此——胸腺依赖性淋巴细胞。T细胞可以分为辅助T细胞(Th)、细胞毒性T细胞(Tc)和调节性T细胞(Treg)。Th/Tc比例的改变会改变机体的免疫功能 [8]。当受到抗原刺激时,T淋巴细胞会转化为淋巴母细胞,然后分化为致敏的T淋巴细胞,参与细胞免疫。它主要抵御细胞内感染、肿瘤细胞和同种异体细胞。
NKT淋巴细胞是具有NK细胞特性的T淋巴细胞亚群 [9],它们既具有T淋巴细胞的抗肿瘤免疫活性,又具有NK细胞的非MHC限制性抗肿瘤特性 [10]。它们在抗感染、抗肿瘤、自身免疫平衡调节等方面起着重要作用[11]。
4.2 T淋巴细胞细胞表面标志物
在T淋巴细胞中,辅助T细胞可以进一步分为Th0、Th1、Th2、Th3(TGF-β)、Th17(IL17)等。
通过相对特异的CD抗原标记可以区分Th1和Th2:
Th1---CD3 +CD4+CD30-
Th2---CD3+CD4+CD30+
研究表明,Th1具有明显的细胞毒性效应,主要分泌细胞因子如IL2、IFN-γ或TNF-β,以协助细胞免疫或参与迟发型超敏反应。Th1细胞表面标志物还包括IL-12β2R [12] 和IL-18R [13]。Th2没有细胞毒性效应,主要分泌细胞因子如IL4、IL5、IL6或IL10,以协助体液免疫,并参与快速型超敏反应。
研究发现 [14],Th1/Th2不平衡紊乱与多种疾病过程有关,如肿瘤免疫、移植免疫和过敏。
在T淋巴细胞中,细胞毒性T细胞(Tc)还可以进一步分为:
Tc1(IFN-γ)和Tc2(IL-4、IL5、IL-10)。
区分Tc1和Tc2的相对特异的CD抗原标记:
Tc1---CD3+CD8+CD30-
Tc2---CD3+CD8+CD30+
以下表格是T淋巴细胞的细胞表面标志物。
表1. 主要CD抗原及其在T细胞表面的分布
| CD抗原 | 分布 |
|---|---|
| CD2(ER) | 所有的T细胞和NK细胞 |
| CD3 | 成熟T细胞 |
| CD4(HIVR) | Th 细胞 |
| CD8 | Tc细胞,部分NK细胞 |
| CD25(IL-2R) | 活化T细胞 |
| CD28 | T 细胞 |
| CTLA-4 | 活化T细胞 |
| CD40L | 活化T细胞 |
4.2.1 CD2
CD2,又称为LFA2,是一种黏附分子,能与绵羊红细胞(SRBC)结合,也被称为绵羊红细胞受体(E受体)。它的配体是LAF3。它增强了T细胞与APCs或靶细胞之间的黏附,并促进T细胞对抗原的识别。其细胞质域可以与多种酪氨酸激酶结合,介导信号传导。
4.2.2 CD3
CD3与TCR跨膜区结合形成稳定的TCR-CD3复合物。在这个复合物中,TCR负责识别抗原肽-MHC分子复合物,而CD3分子负责将激活信号传导到细胞内。
CD3分子的细胞质域含有与免疫细胞激活信号转导有关的免疫受体酪氨酸激活基序(ITAM),表明它参与免疫细胞的激活。
4.2.3 CD4
CD4是T辅助细胞的标记,是一种单链跨膜蛋白。其细胞外结构属于IgSF,有四个IgSF结构域。第一和第二结构域可以与MHCII类分子结合。CD4作为TCR-CD3复合物识别抗原的辅助受体,通过与MHCII分子、p56lek激酶结合,参与信号传导。
4.2.4 CD8
CD8是细胞毒性T细胞的标记,是由α链和β链通过二硫键连接形成的异二聚体,其细胞外结构是IgSF成员。CD8分子的细胞质区域可以与p56lek激酶结合,参与信号传导。CD8+T淋巴细胞能够特异性地杀伤靶细胞,具有抗肿瘤、抗病毒和重要的免疫调节作用,其主要功能是抑制免疫应答 [15]。
CD4和CD8分子将T细胞分为两个明显的亚群。CD4和CD8分别是MHCII类或MHCI类分子的受体,CD4+和CD8+细胞数量和比例的变化反映了机体的免疫功能状态。
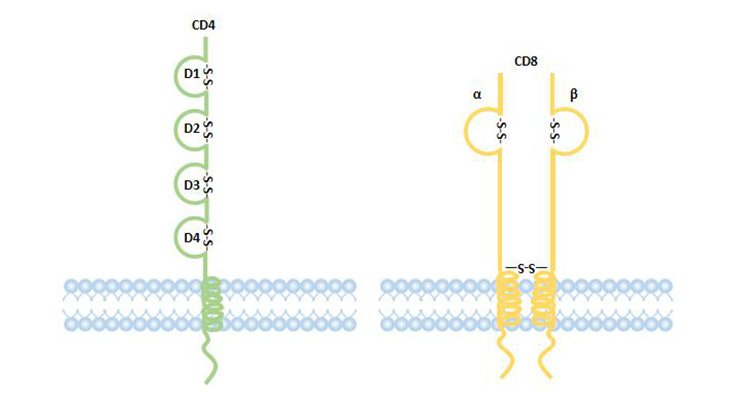
图2. CD4和CD8编译器的结构
4.2.5 CD28 和 CTLA-4(CD152)
它们是经典的共刺激分子。在结构上,两者高度同源,由两个多肽链连接形成同源二聚体。
CD28:在几乎所有CD4+ T细胞中表达,50%的CD8+ T细胞中表达。浆细胞和部分活化的B细胞也表达CD28。
CTLA-4:仅在活化的T细胞上表达。
CD28和CTLA-4的天然配体是B7(CD80/CD86)。
CD28-B7(CD80/CD86)提供了T细胞激活的第二信号(共刺激信号)。
CTLA-4-B7(CD80/CD86)提供了激活的T细胞抑制信号。
4.2.6 CD40L(CD154)
它属于Ⅱ型跨膜蛋白,主要在CD4+ T细胞和CD8+ T细胞表面的激活中表达。CD40L与B细胞表面的CD40相互作用,提供协同刺激信号,促进B细胞增殖、分化、抗体合成和依赖于胸腺抗原(TD-Ag)的免疫应答。
4.2.7 病毒受体
通过这些受体,病毒可以选择性地感染T细胞的一个子群。例如,HIV可以通过感染辅助T细胞(CD4+细胞)来引发艾滋病。
4.2.8 其他表面标志物
包括白细胞介素受体、整合素受体、转铁蛋白受体等。
5. B淋巴细胞及其细胞表面标志物
5.1 B淋巴细胞
B细胞是来源于造血组织的特异性抗原淋巴细胞。与T细胞不同,B细胞在骨髓中分化和成熟。受抗原刺激后,B淋巴细胞首先转化为浆母细胞,然后分化为浆细胞,产生和分泌免疫球蛋白(抗体),参与体液免疫。其功能包括产生抗体、呈递抗原,以及分泌参与免疫调节的细胞因子 [16]。B细胞及其亚群的检测是研究自身免疫疾病和疾病中的免疫调节紊乱的重要指标。
5.2 B细胞表面标志物
5.2.1 B细胞抗原受体,BCR / 表面膜免疫球蛋白,SmIg
它是嵌入在细胞膜脂质分子中的免疫球蛋白,在成熟的B细胞和大多数B细胞肿瘤细胞中表达。成熟的B细胞主要表达mIgM和mIgD,其含量也反映了细胞成熟的程度:IgM > IgD较为不成熟,IgD > IgM较为成熟。
BCR是B细胞最具特征性的表面标志物。它可以特异性地结合相应的抗原,也可以特异性地结合抗免疫球蛋白抗体。
5.2.2 补体受体(CR)
成熟的B细胞表面表达补体受体,主要是C3受体。
补体受体1(CR1),也称为C3b受体或C3b / C4b受体,与C3b和C4b结合,促进B细胞激活。
补体受体2(CD21),B细胞的一个重要标记,也称为C3d受体,同时也是Epstein-Barr病毒的受体。
5.2.3 分化抗原
CD19,CD20,CD21和CD40通常用于B细胞功能分析。
此外,还包括有丝分裂原受体、Fc受体、MHC抗原等表面标志物。
6. 自然杀伤细胞及其细胞表面标志物
6.1 自然杀伤细胞
自然杀伤细胞是胞浆中含有大颗粒的细胞。NK细胞的确切来源尚不明确,一般认为直接来源于骨髓。激活的NK细胞通过分泌细胞因子和细胞毒性 [19]发挥抗病毒 [17]、抗肿瘤 [18]和免疫调节作用。
6.2 NK细胞表面标志物
目前,CD3-CD16+CD56+通常被用作其典型标志。
CD16(FcγRIII),CD56(NCAM-1),CD94,CD158(KIR)和CD161(NKR-P1A)通常用于NK细胞功能分析。
综上所述,淋巴细胞亚群可以通过细胞表面标志物进行区分,见表2。
表2. T、B、NK细胞表面标志物物比较
| 表面标志物 | T 细胞 | B 细胞 | NK 细胞 |
|---|---|---|---|
| 膜表面免疫球蛋白(SmIg) | - | + | - |
| TCR | + | - | - |
| CD2 | + | - | + |
| CD3 | + | - | - |
| CD19, CD20 | - | + | - |
| CD16, CD56 | - | - | + |
| 补体受体 (CR) | - | + | part |
| Fc 受体 | - | + | + |
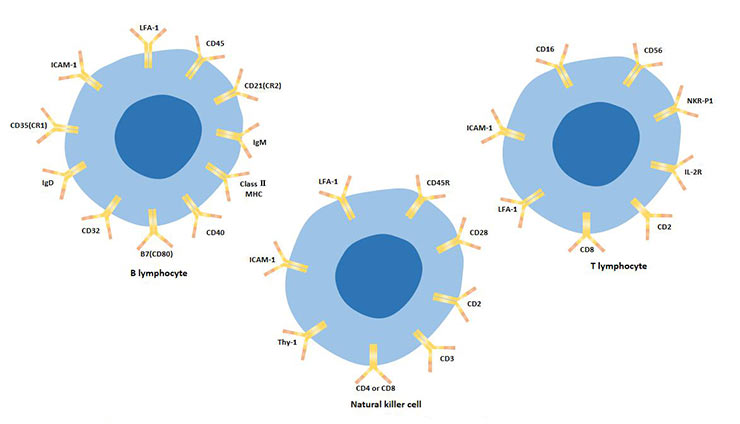
图3. T淋巴细胞、B淋巴细胞和自然杀伤细胞的细胞表面标志物
7. 淋巴细胞的检测
7.1 免疫荧光法
免疫荧光法包括间接免疫荧光法和直接免疫荧光法。
间接免疫荧光法的过程:首先,待检测的细胞经过无标记抗体处理,与特定抗原形成复合物,然后使用荧光标记的抗抗体来检测细胞中特定抗原的存在,从而产生荧光增强效应。
B细胞表面标志物-SmIg可以通过间接免疫荧光法进行检测。
这种方法的特点具有很强的特异性,可以通过显微镜观察准确地确定组织或细胞中荧光的分布情况。
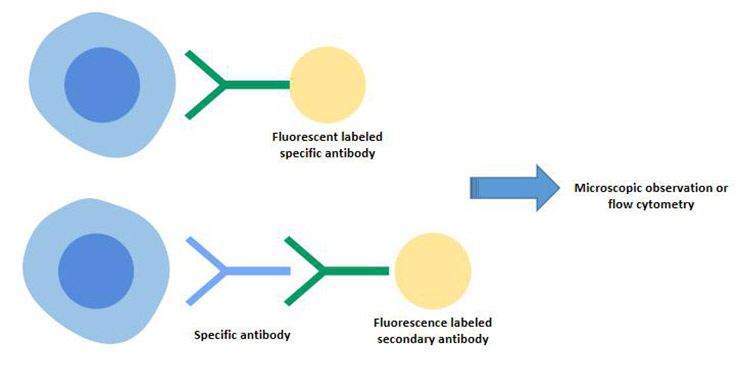
图4. 间接免疫荧光和直接免疫荧光技术
7.2 免疫细胞化学
该方法通常采用酶联免疫测定,如生物素-链霉素系统。通过显微镜,表现为棕黄色的细胞被判定为CD抗原阳性细胞。
7.3 红细胞花环试验
将用相应抗体标记的红细胞作为指示物,与待检测的细胞混合。
羊红细胞(SRBC)与人类淋巴细胞(E花环)自发形成花环 [20] [21]。因此,可以用于检测T细胞上的SRBC受体。这种方法的原理是利用T细胞表面的SRBC受体与SRBC形成花环。
该方法简单,试剂相对便宜。这是一种经典的T淋巴细胞检测方法。但其缺点是结果不太稳定,受个人主观影响。
8. 淋巴细胞表面标志物的应用
淋巴细胞亚群的分析可以揭示患者免疫功能的平衡情况。
8.1 在肿瘤疾病中的应用
机体的免疫功能与恶性肿瘤的发生和发展密切相关。
肿瘤患者外周血的T淋巴细胞亚群异常。患者的CD3+细胞和CD4+细胞显著减少,而CD8+细胞显著增加。这种免疫抑制状态降低了患者识别和杀伤突变细胞的能力。
8.2 在自身免疫性疾病中的应用
自身免疫性疾病患者的淋巴细胞亚群通常受到干扰。淋巴细胞比例的变化与自身免疫性疾病的发生和发展密切相关 [22]。
CD4+/CD8+比率的增加会导致自身免疫疾病 [23]。
淋巴细胞表面标志物还可以用于研究淋巴细胞分化的过程和功能。不同淋巴细胞群体的数量和功能的变化也可能与各种疾病的发生有关。例如,艾滋病患者的CD4+T细胞显著减少甚至缺失。
因此,检测淋巴细胞亚群在控制某些疾病的发生和发展、了解发病机制以及指导临床治疗方面具有重要意义。
参考文献:
[1] Niu J, Chang Y, Lu X, et al. Effect of dendritic cell vaccine therapy on lymphocyte subpopulation in refractory primary brain tumor [J]. Indian J Cancer, 2016, 52(4): 587 -589.
[2] Hsieh CT, Luo YH, Chien CS, et al. Induced pluripotent stem cellconditioned medium suppressed melanoma tumorigenicity through the enhancement of Natural-Killer cellular immunity [J]. J Immunother, 2016, 39(4): 153-159.
[3] Lisse I M, Qureshi K, Poulsen A, et al. T-lymphocyte subsets and eosinophil counts in acute and convalescence chickenpox infection: a household study in Guinea- Bissau [J]. Journal of Infection, 2005, 50(2): 125-129.
[4] Yushchuk N D, Gadzhikulieva M M, Balmasova I P, et al. The role of immune factors in the progression of chronic kidney diseases in HIV infection [J]. Ter Arkh, 2015, 88(3): 56-61.
[5] Bravo Soto JA, Esteban De La Rosa RJ, Luna Del Castillo JD, et al. Effect of mycophenolate mofetil regimen on peripheral blood lymphocyte subsets in kidney transplant recipients [J]. Transplant Proc, 2003, 35(4): 1355-1359.
[6] Cho JH, Yoon YD, Jang HM, et al. Immunologic monitoring of T-Lymphocyte subsets and Hla-Dr-Positive monocytes in kidney transplant recipients: a prospective, observational cohort study [J]. Medicine (Baltimore), 2015, 94(44): e1902.
[7] Papamichail M. T and B Lymphocytes: Origins, Properties and Roles in Immune Responses [J]. Immunology, 1975, 28(1).
[8] Yasutomo K. The cellular and molecular mechanism of CD4/CD8 lineage commitment [J]. Journal of Medical Investigation Jmi, 2002, 49(1-2): 1.
[9] Godfrey D I, Macdonald H R, Kronenberg M, et al. NKT cells: what's in a name? [J]. Nature Reviews Immunology, 2004, 4(3): 231-237.
[10] Yamaguchi Y, Ohshita A, Kawabuchi Y, et al. Adoptive immunotherapy of cancer using activated Autologous lymphocytes-current status and new strategies [J]. Human Cell, 2010, 16(4): 183-189.
[11] Brigl M, Brenner M B. CD1: Antigen Presentation and T Cell Function [J]. Annual Review of Immunology, 2004, 22(1): 817-890.
[12] Rogge L, Barberis - Manino L, Biffi M, et al. Selective expression of an IL - 12 receptor component by human T helper 1 cells [J]. J Exp Med, 1997 , 185: 825-831.
[13] Xu D,Chan WL,Leung BP, et al. Selective expression and functions of IL - 18 recptor on T helper (Th) type 1 but not Th2 cells [J ]. J Exp Med,1998 ,188 (8): 1485-1492.
[14] Mosmann TR, Cherwinski H, BondMW, et al. Two types of murine helper T cell clone. I. Defination according to profiles of lymphokine activities and secreated proteins [J]. J Immunol, 1986 , 136: 2348-2357.
[15] Appay V, Lier R A W V, Sallusto F, et al. Phenotype and function of human T lymphocyte subsets: Consensus and issues [J]. Cytometry, 2008, 73A(11): 975-983.
[16] Yu Q M, Yu C D, Ling Z Q. Elevated Circulating CD19(+) Lymphocytes Predict Survival Advantage in Patients with Gastric Cancer [J]. Asian Pacific journal of cancer prevention, 2012, 13(5): 2219-2224.
[17] Aura M, Marcel C G, Andrea V, et al. Priming of NK Cell Anti-Viral Effector Mechanisms by Direct Recognition of Human Cytomegalovirus [J]. Frontiers in Immunology, 2013, 0-4.
[18] Krzywinska E, Allende-Vega N, Cornillon A, et al. Identification of Anti-tumor Cells Carrying Natural Killer (NK) Cell Antigens in Patients With Hematological Cancers [J]. EBioMedicine, 2015, 2(10): 1364-1376.
[19] Galazka G, Jurewicz A, Domowicz M, et al. HINT1 peptide/Hsp70 complex induces NK-cell-dependent immunoregulation in a model of autoimmune demyelination [J]. Eur J Immunol, 2014, 44(10): 3026-3044.
[20] Lay W H, Mendes N F, Bianco C, et al. Binding of sheep red blood cells to a large population of human lymphocytes [J]. Nature, 1971, 230(5295): 531-2.
[21] Brain P, Gordon J. Rosette formation by peripheral lymphocytes. II. Inhibition of the phenomenon [J]. Clinical & Experimental Immunology, 1971, 8(3): 441-9.
[22] Gopalakrishnan S, Sen S, Adhikari J S, et al. The role of T-lymphocyte subsets and interleukin-5 blood levels among Indian subjects with autoimmune thyroid disease [J]. Hormones (Athens, Greece), 2010, 9(1): 76-81.
[23] Harrington L E, Hatton R D, Mangan P R, et al. Interleukin 17–producing CD4+ effector T cells develop via a lineage distinct from the T helper type 1 and 2 lineages [J]. Nature Immunology, 2005, 6(11): 1123-1132.











