盘状结构域受体DDR1:一种新型RTKs成员,肿瘤治疗潜力靶标!
日期:2022-08-01 11:24:33
新近发现,DDR1是受体酪氨酸激酶(RTKs)中的一员。受体酪氨酸激酶(Receptor Tyrosine Kinases,RTKs)在控制细胞增殖和分化的信号转导通路中扮演重要的角色,并参与肿瘤的发生与发展。近年来,越来越多关于盘状结构域受体(DDR)的研究引起关注,尤其是DDR1,大量研究揭示,DDR1在细胞分化、增殖、黏附、迁移中起重要作用,同时也具有促进细胞恶性转化及肿瘤侵袭、转移的作用。国际顶级期刊Nature早前报道,DDR1的表达,有助于在肿瘤周围建立物理屏障,从而防止T细胞浸润到肿瘤中,阻碍杀伤肿瘤细胞的作用。那么,抑制DDR1,将可阻断DDR1对免疫细胞的抑制作用。因此,DDR1作为一种新型RTKs蛋白,成为具有潜力的癌症治疗靶点之一。
1、DDR的发现
在1993年,Johnson等人在研究乳腺癌细胞中的酪氨酸磷酸化时,发现盘状结构域受体(Discoidin domain receptor,DDR),被认为是跨膜受体酪氨酸激酶(RTKs)超家族的成员。现已鉴定出了2种类型DDR,即DDR1和DDR2 [1]。DDR由胞内激酶区、跨膜区和胞外区3部分组成。与RTKs家族的其他成员不同的是,DDR在胞外结构域中存在盘状结构discoidin region(DR),所以被称为盘状结构域受体型蛋白酪氨酸激酶。DDR作为一种新型的RTKs,在研究者探索酪氨酸激酶蛋白的表达与人恶性肿瘤中的关系时被发现的,盘状结构域受体可能是肿瘤发生发展的重要因素。陆续研究表明,DDR与肿瘤细胞的侵袭和转移有关,能促进细胞恶性增殖。另有研究表明DDR与纤维化、神经系统变性有关。对DDR的深入研究,或为临床上预防肿瘤等疾病的发生发展提供依据(图1) [2]。
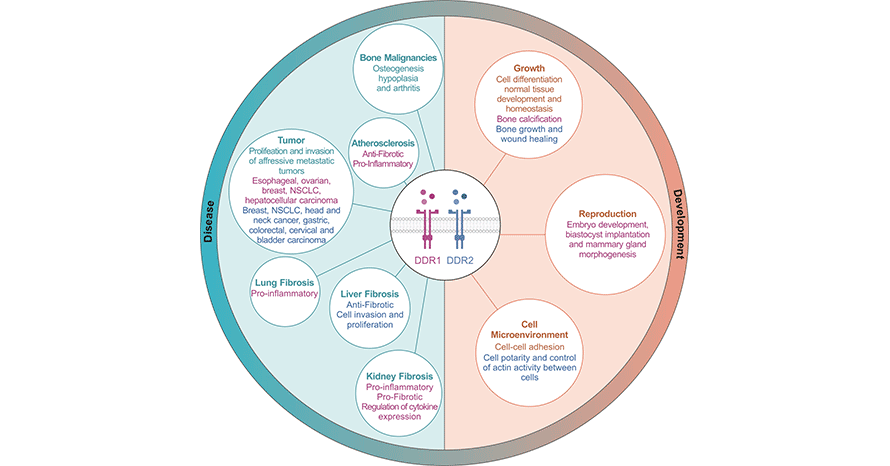
图1. DDR与肿瘤等疾病联系密切 [2]
2、什么是DDR1?
DDR1(Discoidin domain receptor 1)作为DDRs成员之一,属于一种新型的受体型酪氨酸激酶(RTKs)。DDR1基因位于人6号染色体的p臂(6p21.3)。DDR1由与配体相互作用的细胞外结构域、跨膜区和通过激酶结构域传递信号的细胞质内结构组成(图2) [3]。DDR1有5种亚型,即5个剪接变异体,DDR1a、DDR1b、DDR1c、DDR1d和DDR1e,由外显子的选择性剪接或缺失产生。目前,被证实有生物学功能的亚型为DDR1a和DDR1b。研究表明,不少蛋白能与活化后的DDR1结合,非肌肉肌球蛋白重链IIA(Non-myscle myosin heavy chain IIA, NMHC-IIA),黏着斑激酶(Focal adhesion kinase,FAK),STAT3,Lyn等。但某些蛋白与DDR1的结合不需要DDR1的磷酸化,如多巴胺和cAMP调节的磷蛋白、肾脑表达蛋白、Notch1、E-钙黏蛋白(Cadherin-1,CADH1) [4-8]。
DDR1主要表达于上皮细胞,平滑肌细胞、成纤维细胞、少突胶质细胞和巨噬细胞,且DDR1与肾脏、肝脏、肺组织的纤维化病变有关。此外,DDR1酪氨酸激酶在多种肿瘤中均有表达,如肺癌、乳腺癌、脑瘤、卵巢癌、食管癌、头颈部肿瘤、肝癌、睾丸癌等,其高表达与肿瘤预后不良密切相关。鉴于DDR1功能的改变和肿瘤的发展之间的联系,使得DDR1成为癌症治疗的新靶点 [9-10]。目前,已有多款靶向DDR1在研临床药物,主要用于癌症治疗。
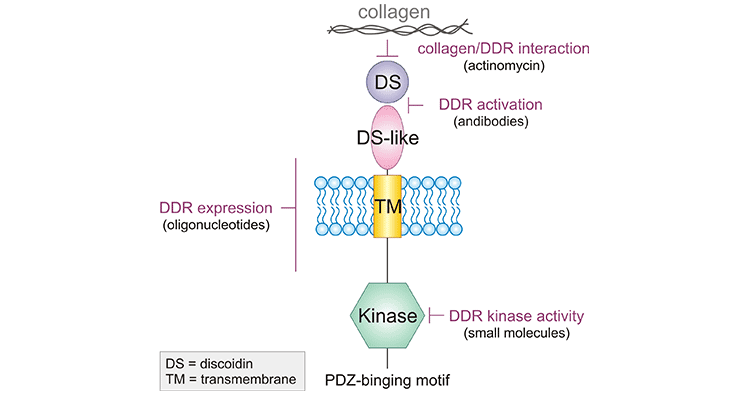
图2. DDR1的结构 [3]
3、DDR1的配体
典型的RTK的配体是可溶的生长因子,DDRs酪氨酸激酶的配体是胞外基质的关键成分——胶原蛋白。DDR1可与I、II、III、IV型胶原结合,对X型胶原,则亲和力较低。DDRs酪氨酸激酶能识别胶原蛋白上的特定的氨基酸序列GVMGFO。胶原蛋白与盘状结构域受体结合后,最终导致酪氨酸激酶的缓慢而持续的激活(图3) [3]。
大多数受体酪氨酸激酶的活化是快速激活和快速失活,酪氨酸残基的磷酸化激活发生在配体结合的几秒钟内,随后是由去磷酸化或者受体/配体内化降解所导致的活性的快速下调。但是,DDR1活化的方式与大多数受体酪氨酸激酶不一样。DDR1的活化形式是缓慢激活和缓慢失活,具有较长的磷酸化状态。有研究表明,在暴露胶原配体刺激下,DDR1于30分钟左右才能被磷酸化,并至少可持续16小时 [11]。无论如何,异常的酪氨酸激酶的活化与肿瘤的发生、发展相关。也就是说,DDR1主要通过胶原蛋白激活,参与癌细胞的增殖、迁移、侵袭和基质重塑。
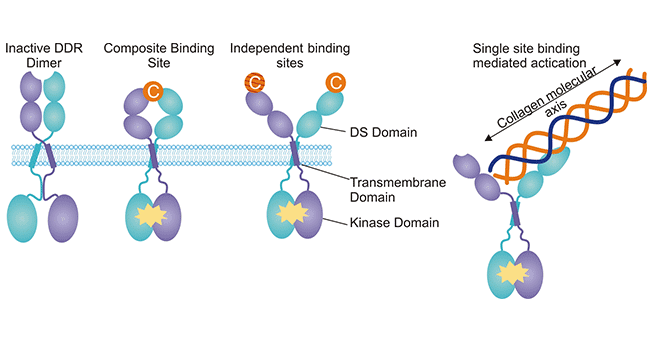
图3. DDR1结合胶原蛋白 [3]
4、DDR1的调节机制
目前,关于DDR1的研究,DDR1主要是通过这三个机制发挥作用:1)经典的collagen-DDR1信号通路,依赖于DDR1激酶活性,直接下游分子为Shc,Nck2,Shp-2等;2)依赖collagen的刺激,但是不依赖DDR1激酶活性,也称为非经典的DDR1信号通路;3)不依赖collagen的刺激,也不依赖DDR1激酶活性,而发挥作用。
DDR1在大多数情况下是依赖它的激酶活性发挥作用的,有文献发现,激活的DDR1招募PSD4与ARF6结合,从而激活ARF6及其下游MAPK信号通路,进而促进肝癌细胞的肺转移 [11]。另有研究提示,激活的DDR1通过Ras和Raf引起MAPK信号通路的激活,从而促进p19 ARF的表达,继而诱导P53的表达 [12]。脂肪组织中,基质血管成分(SVF)中的DDR1促进了IL-6的分泌,IL-6对于SVF促肿瘤细胞的侵袭非常重要,说明肿瘤外的DDR1也可以促进肿瘤的进展 [13]。如上所说,DDR1可通过一种非经典的通路发挥促癌作用,如,在乳腺癌细胞中,TM4SF1充当膜衔接蛋白的功能,招募syntenin 2与DDR1相互作用,从而激活PKC,继而激活JAK2及其下游STAT3,非经典通路诱导了SOX-2和NANOG的表达,维持了癌干细胞的特性 [14-15]。因此,DDR1可充当促肿瘤生存因子的作用,说明DDR1是一种潜在的肿瘤治疗靶点(图4) [3]。
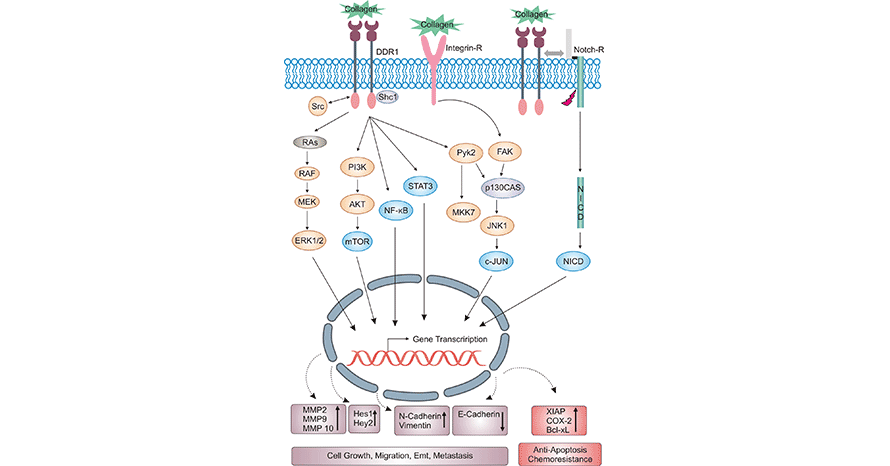
图4. DDR1相关的信号通路 [3]
5、DDR1在肿瘤中的作用
5.1 DDR1与肿瘤的增殖、生长
DDR1在非恶性和恶性肿瘤细胞中均可促进细胞的增殖与生长,非恶性细胞,如在原代人支气管上皮细胞、T细胞等;肿瘤细胞,如人胶质瘤细胞、结肠癌细胞、肝癌细胞等等。DDR1在某些非恶性肿瘤细胞中起着抑制增殖与生长的作用,如原代鼠系膜细胞,但是尚未有文献报道DDR1能抑制恶性肿瘤细胞的增殖与生长。研究表明,在人乳腺癌和结肠癌中,DDR1主要是通过激活Ras/Raf/ERK和PI3K/Akt通路,从而上调抗凋亡蛋白Bcl-xL和使得细胞在基因毒性应激状态下存活下来 [5, 16-17]。
5.2 DDR1与肿瘤的侵袭、转移
在肿瘤中,盘状结构域受体酪氨酸激酶通过破坏正常的细胞-基质中的信号传递,从而促进肿瘤细胞的侵袭和转移。研究表明,盘状结构域受体酪氨酸激酶能促进多种人类肿瘤的侵袭,如乳腺癌、肺癌、睾丸癌等 [9-10]。在人胰腺癌细胞AsPC-1中,DDR1表达质粒转染AsPC-1,AsPC-1细胞DDR1蛋白表达量显著升高;Transwell试验结果显示,AsPC-1/DDR1迁移力上调,侵袭力上调。过表达DDR1后,AsPC-1细胞中MMP2和MMP9表达水平显著升高。由此说明,DDR1可通过改变MMP2和MMP9的表达水平,促进胰腺癌细胞的迁移及侵袭 [18]。
5.3 DDR1与肿瘤的EMT
上皮细胞-间充质细胞转化(EMT)在胚胎发育、慢性炎性反应、组织重建、癌症转移和多种纤维化疾病中发挥重要作用。通过EMT,上皮细胞失去细胞极性,失去与基质膜的连接等上皮表型,获得较高的迁移、侵袭、抗凋亡和降解细胞外基质的能力等间质表型 [19-20]。有研究表明,DDR1通过促进EMT增加非小细胞肺癌细胞的侵袭和迁移能力。进一步的研究揭示,DDR1的过表能促进胃癌细胞的上皮间质转化,与Snail信号通路激活有关 [21]。Snail参与的信号途径,与上皮间质转化有着密不可分的关系。Snail可通过抑制E-cadherin诱导的上皮间质转化,加速肿瘤的淋巴结及远处转移 [22];也有研究表明,Snail/HDAC1/HDAC2复合体通过抑制E-cadherin促进胰腺癌的EMT,从而促进肿瘤的转移能力 [23]。DDR1在肿瘤的EMT进程中所发挥的作用,仍需进一步探索 。
5.4 DDR1与肿瘤微环境TME
有研究指出,在肿瘤发展过程中,DDR1可以使细胞外基质(ECM)变为高度有序的状态,阻碍免疫细胞浸润及其杀伤肿瘤细胞的作用。进一步分析发现,在TNBC小鼠模型中敲除DDR1,可以促进肿瘤内T细胞的浸润,并能抑制肿瘤的生长。因此,敲除DDR1基因或通过抑制DDR1,有可能阻断肿瘤的抗免疫监控的能力,让免疫细胞成功进入肿瘤杀伤肿瘤细胞 [24]。DDR1可能是阻止免疫细胞靠近肿瘤的关键蛋白。因此,DDR1有望成为肿瘤免疫治疗的新靶标。
6、DDR1的临床应用前景
目前,多家国内外药企已开展以DDR1为靶点的药物临床试验,用于肿瘤等疾病治疗,包括北京诺诚健华医药科技、韩国Avixgen, Inc.、美国KeifeRx LL等等。一般而言,酪氨酸激酶抑制剂主要是针对酪氨酸激酶活性和功能而设计,包括破坏细胞内的激酶活性的化学小分子和旨在干扰胞外结构域功能的单克隆抗体。现在临床研究所用的DDR1拮抗剂,主要是小分子化药,用于癌症、神经系统变性病、阿尔茨海默病等疾病的治疗(表1)。
有临床前研究提示,DDR1抑制剂在肝癌、乳腺癌、结肠直肠癌、胃癌、食管癌和NSCLC患者来源的肿瘤移植小鼠模型中,表现出广泛且很强的抗肿瘤活性。随着对盘状结构域受体酪氨酸激酶的深入研究,DDR1作为一种新型的RTKs成员,有潜力成为开发新型抗肿瘤药物的重要靶标之一,值得持续关注。
| 药物 | 作用机制 | 在研适应症 | 最高研发状态 | 在研机构 | 药物类型 |
|---|---|---|---|---|---|
| ICP-033 | DDR1拮抗剂 、受体蛋白酪氨酸激酶抑制剂、VEGFR1拮抗剂 |
实体瘤; 前列腺癌; 卵巢癌; 肾细胞癌; 结直肠癌; 肝癌 |
临床1期 | 北京诺诚健华医药科技有限公司 | 小分子化药 |
| AVI-4015 | DDR1拮抗剂 | 干眼综合征 | 临床1期 | Avixgen, Inc. | 化学药 |
| Gutinib 2 | DDR1拮抗剂 | 神经系统变性病 | 临床前 | KeifeRx LLC | 小分子化药 |
| PRTH 101 | DDR1拮抗剂 | 肿瘤 | 临床前 | Parthenon Therapeutics, Inc. | 未知 |
| Discoidin Domain Receptor Inhibitors(Redx Pharma) | DDR1拮抗剂 | 纤维化 | 临床前 | 莱德克斯制药公共有限公司 | 小分子化药 |
| Gutinib 1 | DDR1拮抗剂 | 神经系统变性病 | 临床前 | KeifeRx LLC | 小分子化药 |
| BK-40143 | DDR1拮抗剂、 DDR2抑制剂 |
阿尔茨海默病 | 临床前 | Georgetown University Law Center | 小分子化药 |
表1:DDR1临床研究进展
为鼎力协助各药企针对DDR1在肿瘤、神经系统变性病等疾病在临床中的研究,CUSABIO推出DDR1活性蛋白产品(Code: CSB-MP006595HU,助力您在DDR1机制方面的研究或其潜在临床价值的探索。
● Recombinant Human Epithelial discoidin domain-containing receptor 1(DDR1),partial (Active)
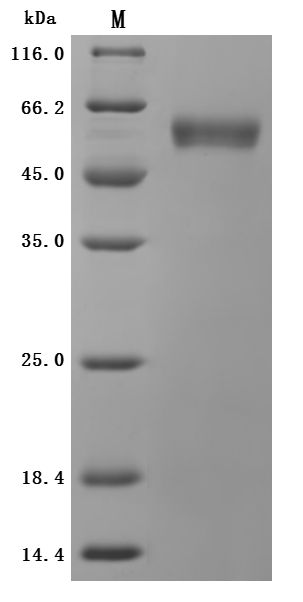
The purity was greater than 95% as determined by SDS-PAGE. (Tris-Glycine gel) Discontinuous SDS-PAGE (reduced) with 5% enrichment gel and 15% separation gel.

Immobilized Human DDR1 at 2 μg/ml can bind Anti-DDR1 recombinant antibody (CSB-RA006595MA1HU), the EC50 is 2.824-3.810 ng/mL.
参考文献:
[1] Vogel, Wolfgang F., Rahim Abdulhussein, and Caroline E. Ford. "Sensing extracellular matrix: an update on discoidin domain receptor function." Cellular signalling 18.8 (2006): 1108-1116.
[2] Gao, Yuan, Jiuli Zhou, and Jin Li. "Discoidin domain receptors orchestrate cancer progression: A focus on cancer therapies." Cancer Science 112.3 (2021): 962-969.
[3] Chen L, Kong X, Fang Y, et al. Recent Advances in the Role of Discoidin Domain Receptor Tyrosine Kinase 1 and Discoidin Domain Receptor Tyrosine Kinase 2 in Breast and Ovarian Cancer[J]. Frontiers in Cell and Developmental Biology, 2021: 3078.
[4] Huang Y, Arora P, McCulloch C A, et al. The collagen receptor DDR1 regulates cell spreading and motility by associating with myosin IIA[J]. Journal of cell science, 2009, 122(10): 1637-1646.
[5] Matada G S P, Das A, Dhiwar P S, et al. DDR1 and DDR2: A review on signaling pathway and small molecule inhibitors as an anticancer agent[J]. Medicinal Chemistry Research, 2021, 30(3): 535-551.
[6] Lin Y, Jin H, Wu X, et al. The cross-talk between DDR1 and STAT3 promotes the development of hepatocellular carcinoma[J]. Aging (Albany NY), 2020, 12(14): 14391.
[7] Matada G S P, Das A, Dhiwar P S, et al. DDR1 and DDR2: A review on signaling pathway and small molecule inhibitors as an anticancer agent[J]. Medicinal Chemistry Research, 2021, 30(3): 535-551.
[8] Yeh Y C, Lin H H, Tang M J. Dichotomy of the function of DDR1 in cells and disease progression[J]. Biochimica et Biophysica Acta (BBA)-Molecular Cell Research, 2019, 1866(11): 118473.
[9] Kim H G, Tan L, Weisberg E L, et al. Discovery of a potent and selective DDR1 receptor tyrosine kinase inhibitor[J]. ACS chemical biology, 2013, 8(10): 2145-2150.
[10] Elkamhawy A, Lu Q, Nada H, et al. The journey of DDR1 and DDR2 kinase inhibitors as rising Stars in the fight against cancer[J]. International Journal of Molecular Sciences, 2021, 22(12): 6535.
[11] Zhang X, Hu Y, Pan Y, et al. DDR1 promotes hepatocellular carcinoma metastasis through recruiting PSD4 to ARF6[J]. Oncogene, 2022, 41(12): 1821-1834.
[12] Chetoui N, El azreq M A, Boisvert M, et al. Discoidin domain receptor 1 expression in activated T cells is regulated by the ERK MAP kinase signaling pathway[J]. Journal of cellular biochemistry, 2011, 112(12): 3666-3674.
[13] Sun X, Gupta K, Wu B, et al. Tumor-extrinsic discoidin domain receptor 1 promotes mammary tumor growth by regulating adipose stromal interleukin 6 production in mice[J]. Journal of Biological Chemistry, 2018, 293(8): 2841-2849.
[14] Gao H, Chakraborty G, Zhang Z, et al. Multi-organ site metastatic reactivation mediated by non-canonical discoidin domain receptor 1 signaling[J]. Cell, 2016, 166(1): 47-62.
[15] Bruno A, Bassani B, Pelosi G, et al. Proffered abstracts from the 17th Biennial Congress of the Metastasis Research Society[J]. Clin. Exp. Metastasis, 2019, 36: 139-170.
[16] Matà R, Palladino C, Nicolosi M L, et al. IGF-I induces upregulation of DDR1 collagen receptor in breast cancer cells by suppressing MIR-199a-5p through the PI3K/AKT pathway[J]. Oncotarget, 2016, 7(7): 7683.
[17] Zhu Q D, Zhou Q Q, Dong L, et al. MiR-199a-5p inhibits the growth and metastasis of colorectal cancer cells by targeting ROCK1[J]. Technology in cancer research & treatment, 2018, 17: 1533034618775509.
[18] Yang J, Zhang Y, He S, et al. TM4SF1 promotes metastasis of pancreatic cancer via regulating the expression of DDR1[J]. Scientific reports, 2017, 7(1): 1-8.
[19] Xie X, He H, Zhang N, et al. Overexpression of DDR1 promotes migration, invasion, though EMT-related molecule expression and COL4A1/DDR1/MMP-2 signaling axis[J]. Technology in Cancer Research & Treatment, 2020, 19: 1533033820973277.
[20] Yeh Y C, Lin H H, Tang M J. Dichotomy of the function of DDR1 in cells and disease progression[J]. Biochimica et Biophysica Acta (BBA)-Molecular Cell Research, 2019, 1866(11): 118473.
[21] Xie R, Wang X, Qi G, et al. DDR1 enhances invasion and metastasis of gastric cancer via epithelial-mesenchymal transition[J]. Tumor Biology, 2016, 37(9): 12049-12059.
[22] Nagaraja S G S, Subramanian U, Nagarajan D. Radiation-induced H3K9 methylation on E-cadherin promoter mediated by ROS/Snail axis: role of G9a signaling during lung epithelial-mesenchymal transition[J]. Toxicology in Vitro, 2021, 70: 105037.
[23] Hastreiter S T. Systematic analysis of the class I histone deacetylases HDAC1, HDAC2 and HDAC3 in pancreatic cancer[D]. Technische Universität München, 2021.
[24] Sun X, Wu B, Chiang H C, et al. Tumour DDR1 promotes collagen fibre alignment to instigate immune exclusion[J]. Nature, 2021, 599(7886): 673-678.











