新兴SEMA4D抑制剂崭露头角,克服免疫治疗耐药难题?
日期:2022-04-26 10:58:31
2022年4月,美国癌症研究协会(AACR)年会公布了首个靶向SEMA4D的抗体-Pepinemab,在治疗复发性或转移性头颈癌患者的1b/2期临床数据(NCT04815720),结果表明Pepinemab具有良好的耐受性和安全性,为癌症患者的治疗提供了一个极具潜力的新方向 [1]。目前,该项目的2期临床扩展阶段正在招募患者,其研究的主要终点是客观缓解率(ORR),这些研究将有望支持SEMA4D靶点作为癌症患者一线治疗的巨大潜力。既往临床数据证明,Pepinemab联合阿维鲁单抗(Bavencio),在晚期非小细胞肺癌患者治疗中,同样获得了良好的耐受和显著疗效。SEMA4D作为新发现的重要免疫调节分子,大量数据证明SEMA4D参与到肿瘤调控过程中,且与耐药机制密切相关。那么,什么是SEMA4D?SEMA4D在肿瘤等疾病中的研究进展如何?今天,我们一起来了解一下。
1、什么是SEMA4D?
SEMA4D(轴突导向蛋白4D,又称为CD100),是分子量为150 kDa的跨膜型同源二聚体蛋白,且为脑信号蛋白(Semaphorins)家族的重要成员之一 [2]。SEMA4D分子结构主要包括:SEMA结构域、富含半胱氨酸结构域(cysterine-rich domain,CRD)和免疫球蛋白结构域(immunolobulin,Ig)(图1)[3]。SEMA和CRD结构域为Semaphorins家族所共有的结构。SEMA结构域不仅是SEMA4D蛋白进行信号转导的分子基础,且决定了反应的特异性。CRD结构域与细胞膜间单独存在Ig样结构域,为SEMA4D所特有,可直接与细胞膜结合。SEMA4D以二聚体形式存在于细胞表面,细胞活化时它可以裂解释放出具有生物活性的可溶性蛋白SEMA4D(图1) [3, 4]。
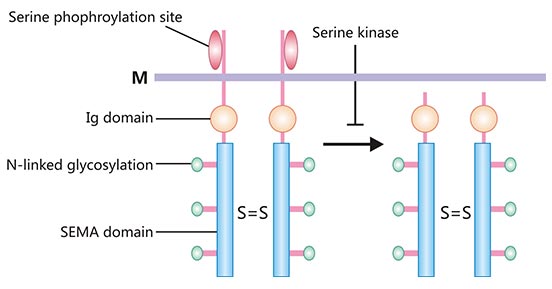
图1. SEMA4D蛋白结构示意图
SEMA4D广泛表达于人体的多种组织和器官,在胚胎及成人组织中均有表达,其中包括非淋巴组织(心、脑和肾)和淋巴组织(脾、胸腺和淋巴结)[4, 5]。通过多种信号转导途径,SEMA4D在神经系统的轴突向导、免疫系统T、B细胞的活化和免疫调节等方面发挥重要的生物学功能 [6]。近年来,大量研究发现SEMA4D在许多人体肿瘤组织中高表达,且对肿瘤血管新生以及肿瘤侵袭转移起重要作用 [7]。
2、SEMA4D的受体有哪些?
目前,SEMA4D主要有3个受体,分别是Plexin-B1、Plexin-B2和CD72 [8]。Plexin-B1属于跨膜蛋白Plexins家族的重要成员之一,最初从小鼠肾脏来源的细胞上发现 [9]。Plexin-B1作为SEMA4D的高亲和力受体,是形成SEMA4D受体复合物的重要组成部分。
Plexin-B1分子量为300 kDa,由全长2135氨基酸的糖蛋白构成,包括α和β两个亚基 [9]。Plexin-B1在多种组织中表达,如消化系统、甲状腺、前列腺等 [9]。SEMA4D结合Plexin-B1后,可使Met酪氨酸激酶活化(图2)。SEMA4D、Plexin-B1和Met形成复合物,激活下游信号通路,参与血管形成、细胞侵袭以及细胞迁移等生物学活动 [10]。
除了高亲和力受体Plexin-B1,SEMA4D可与低亲和力受体CD72和Plexin-B2结合(图2)。CD72为分子量45 kDa的Ⅱ型跨膜蛋白,其属于C型凝集素超家族 [11]。CD72主要表达于免疫细胞,如B细胞、APC及肥大细胞等 [12]。在人肥大细胞中,CD72/SEMA4D复合物,能抑制肥大细胞增殖、趋化因子和细胞因子的产生 [6, 13]。另外,Plexin-B2也属于跨膜蛋白Plexins家族,其分子量为240 kDa,存在于各种组织中 [14]。大量研究发现,SEMA4D通过结合高亲和受体Plexin-B1参与免疫反应、神经生长、骨生长、血栓形成以及肿瘤血管新生等 [6]。
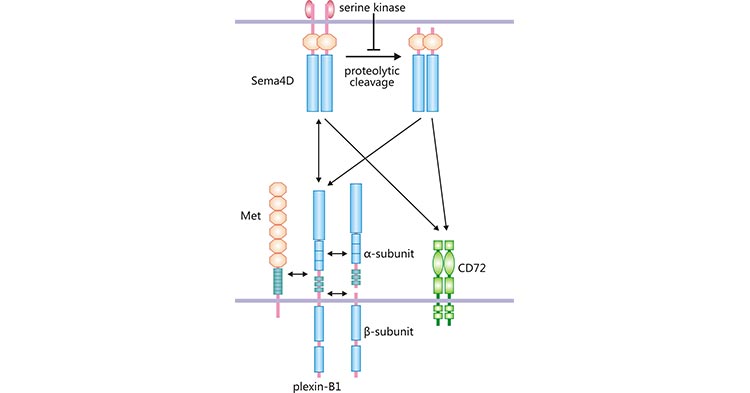
图2. SEMA4D与不同的受体结合
3、SEMA4D介导的信号通路是什么?
目前的研究主要集中在SEMA4D结合高亲和受体Plexin-B1介导的信号通路。如图3所示,SEMA4D结合Plexin-B1受体后,活化ERBB2、Met或者RON酪氨酸激酶途径,激酶活化后可诱导ERBB2、Met和RON下游的信号分子(比如Gab1和Shc)的磷酸化 [16]。ERBB2、Met或RON信号激活是SEMA4D/Plexin-B1介导细胞增殖、迁移和侵袭的条件 [17, 18]。在肿瘤细胞中,血管生成是恶性肿瘤侵袭转移的重要环节。SEMA4D与Plexin-B1结合后促使一系列级联式反应发生,从而介导肿瘤血管生成,但其具体过程仍然存在争议。
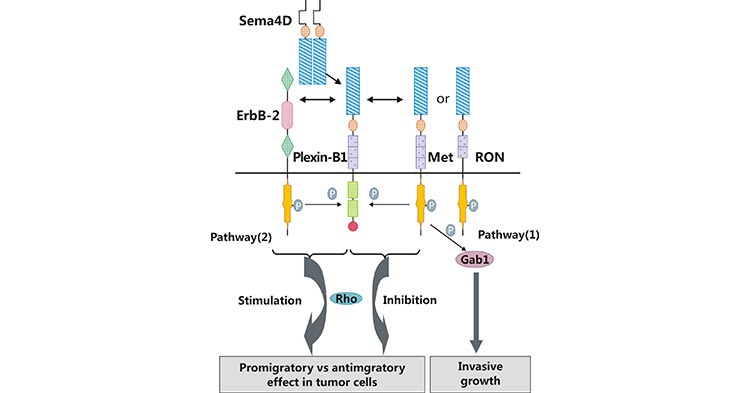
图3. SEMA4D结合Plexin-B1激活下游通路
有研究认为SEMA4D,借助受体Plexin-B1,通过Rho信号转导途径促进血管生成(图3) [16]。另外有研究认为,SEM4D的促血管生成作用是通过Met激活,继而在酪氨酸磷酸化的过程中实现的 [19]。总而言之,SEMA4D通过结合高亲和受体Plexin-B1,可激活下游信号转导途径,引起细胞的增殖和迁移的变化,进而发挥其生物学功能。
4、SEMA4D与哪些疾病相关?
4.1 SEMA4D和自生免疫性疾病
SEMA4D作为一种具有免疫特异性的分泌和膜结合蛋白,其在少突胶质细胞迁移、中枢神经系统炎症和神经系统变性中起重要作用。SEMA4D或SEMA4D/Plexin-B1表达发生异常,可能造成中枢神经系统相关疾病,如神经炎症性脱髓鞘病 [4]、多发性硬化症等 [20]。
4.2 SEMA4D和肾脏相关疾病
除了神经系统,SEMA4D在肾小管中表达,调控肾脏免疫机制。采用实验性免疫复合物(IC)肾小球肾炎模型,发现高表达的SEMA4D,能增强T细胞和B细胞的应答反应,引起肾小球损伤,导致肾小球肾炎。SEMA4D的受体Plexin-B1在肾小管和肾小球中均有表达,研究发现,SEMA4D/Plexin-B1复合物可能是引起肾脏巨噬细胞募集,诱导肾炎的重要机制 [21]。
4.3 SEMA4D和骨相关疾病
众多研究显示,SEMA4D表达于破骨细胞,其高亲和受体Plexin-B1在成骨细胞中表达 [22]。研究提示,破骨细胞上表达的SEMA4D结合成骨细胞上的Plexin-B1,可上调RhoA蛋白表达,下调IGF-1蛋白表达,从而抑制骨形成。采用骨质疏松的动物模型中,SEMA4D特异性抗体处理可防止骨丢失,改善骨质疏松 [22]。
4.4 SEMA4D和肿瘤相关疾病
越来越多的研究表明,SEMA4D在肿瘤细胞中高表达,包括头颈鳞状细胞癌 [23]、肺癌 [24]、胃癌 [25]、乳腺癌 [26]、骨肉瘤 [27]、卵巢癌 [28]和宫颈癌 [29]。SEMA4D作为重要的促血管生成因子,通过促进血管生成而发挥对肿瘤的促进作用。
研究发现,在头颈鳞状细胞癌中,SEMA4D/Plexin-B1高表达,诱导内皮细胞的迁移,促进肿瘤新生血管生成介导癌细胞发生转移;敲低SEMA4D表达,能显著抑制癌细胞的生长或转移 [23]。另外,采用乳腺癌成瘤模型,发现肿瘤微环境中SEMA4D的下调,能抑制微血管形成能力和转移能力 [26]。
此外,在肺癌和胃癌中,有高水平的SEMA4D和Plexin-B1,沉默SEMA4D表达,能显著地抑制肿瘤细胞增殖 [24, 25]。在卵巢癌及骨肉瘤中,高表达SEMA4D的患者,其无疾病进展生存期及总生存期缩短 [27, 28]。在宫颈癌中,下调SEMA4D表达能改善患者总生存时间 [29]。
SEMA4D的研究还见于前列腺癌、结肠癌、B细胞型非霍奇金淋巴瘤和嗜神经性恶性肿瘤等等 [30-32]。因此,进一步研究SEMA4D在各肿瘤中的表达和作用机制,将对肿瘤的发病机制、治疗和预防等具有重要的意义。
5、SEMA4D的研发药物及临床前景
越来越多的证据表明,SEMA4D在神经系统、免疫调节、血管生成、肿瘤侵袭转移等方面均起着重要作用。来自Pharmsnap的最新数据显示,靶向SEMA4D的在研临床药物,目前仅有美国Vaccinex公司的Pepinemab(派比奈单抗),已处于临床II期。Pepinemab是一种人源化单抗,可靶向并阻断SEMA4D的信号活动,克服免疫排斥和骨髓抑制的耐药机制,其适应症为头颈鳞状细胞癌,非小细胞肺癌、阿尔茨海默病、多发性硬化等。临床数据表明,在治疗头颈鳞状细胞癌和晚期非小细胞肺癌中,SEMA4D抗体Pepinemab取得了重大进展,其耐受性良好,具有强大的抗肿瘤活性。
随着对SEMA4D的受体和信号转导研究的深入,大量数据证明SEMA4D是参与免疫相关疾病的重要分子。近年来,免疫治疗早治疗早受益的观点已经被临床普遍接受。但免疫治疗的耐药往往会限制患者的疗效。因此,耐药治疗方案已逐渐成为免疫治疗的重要研究方向。另外,有研究提示,在临床前动物模型中,SEMA4D抗体与免疫检查点抑制剂(包括抗CTLA-4、抗LAG3、抗PD-L1、抗TGFβ)联合用药时,可增强T细胞的浸润和活化,并导致持久的肿瘤消退 [33-35]。
SEMA4D作为一个新兴的免疫调节分子,SEMA4D高表达提示肿瘤细胞恶性程度较高,而之前的研究也表示SEMA4D表达强弱预示着血管生成能力的强弱,因此SEMA4D有望作为抗肿瘤治疗的靶标。目前国内外仅Pepinemab在研临床药物,具有较大的开发潜力。我们期待在不久的未来,研究者们能够研发出针对SEMA4D为靶点的药物。
为鼎力协助各药企针对SEMA4D在癌症等疾病的药物研发工作,CUSABIO推出多款SEMA4D活性蛋白产品(CSB-MP835707HUd9;CSB-MP3947MOW;CSB-MP020990MO;CSB-MP835707HU),助力您在SEMA4D机制方面的研究或其潜在临床价值的探索。
High Purity Validated by Western Blot
Recombinant Huma SEMA4D, partial (Active)
CSB-MP835707HUd9
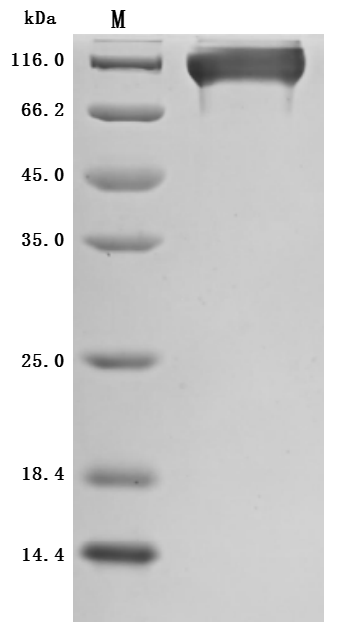
Recombinant Macaca mulatta SEMA4D, partial (Active)
CSB-MP3947MOW
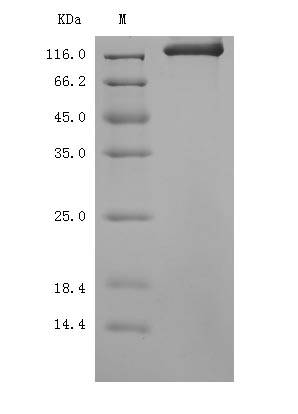
Recombinant Mouse SEMA4D, ,partial (Active)
CSB-MP020990MO
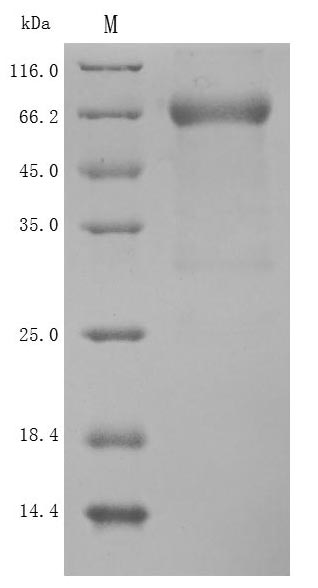
Recombinant Human SEMA4D, partial (Active)
CSB-MP835707HU
Excellent Bioactivity Validated by Functional ELISA
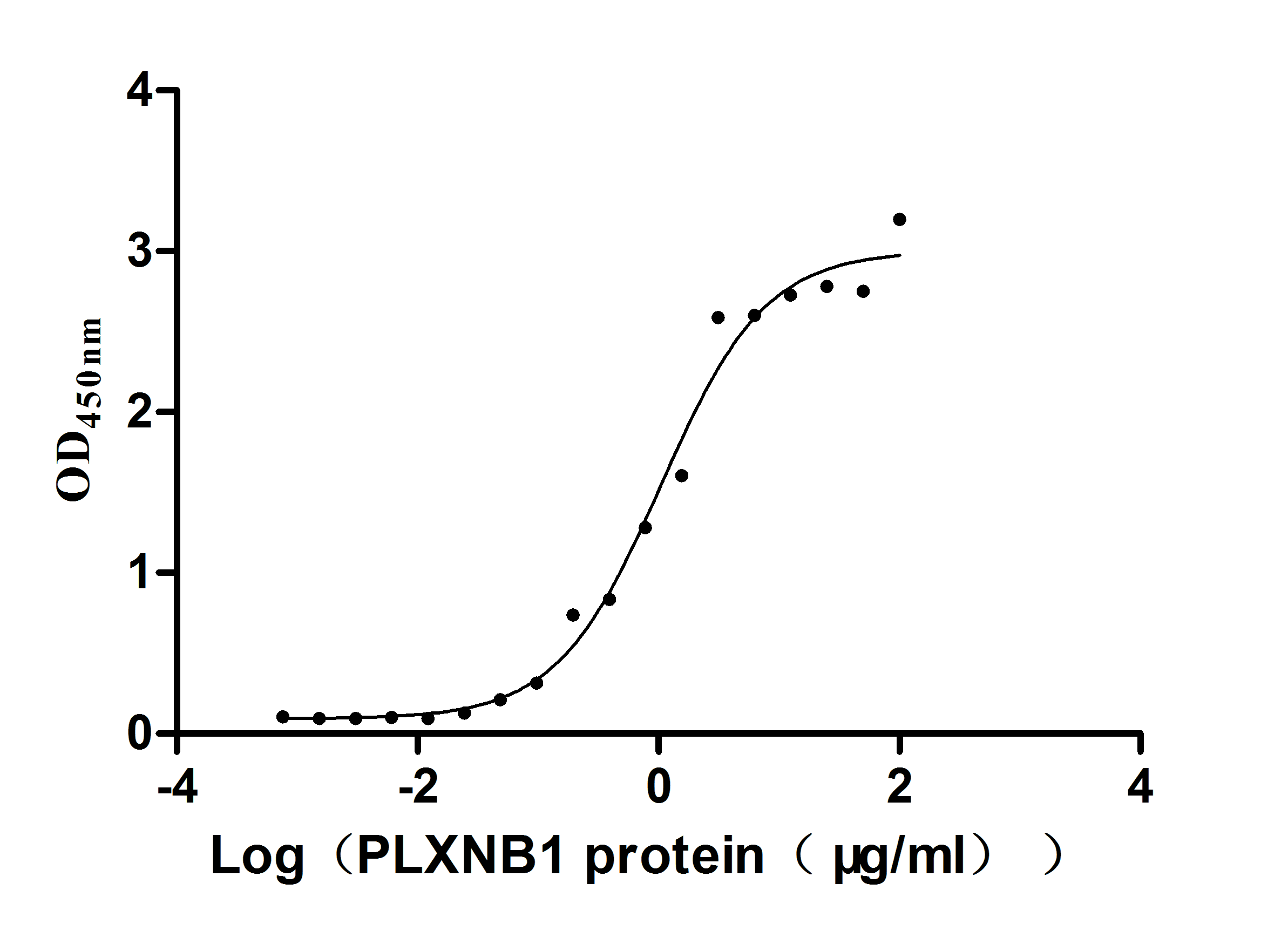
Recombinant Huma SEMA4D, partial (Active)
CSB-MP835707HUd9
Recombinant Macaca mulatta SEMA4D, partial (Active)
CSB-MP3947MOW
Recombinant Mouse SEMA4D, ,partial (Active)
CSB-MP020990MO
Recombinant Human SEMA4D, partial (Active)
CSB-MP835707HU
参考文献:
[1] Fisher, Terrence L., et al. "Phase 1/2 Study of Pepinemab in Combination with Pembrolizumab as First-Line Treatment of Advanced, Recurrent or Metastatic Head and Neck Cancer (KEYNOTE B84)." International Journal of Radiation Oncology, Biology, Physics 112.5 (2022): e36.
[2] Kuklina, Elena, Irina Nekrasova, and Natalia Glebezdina. "Signaling from membrane semaphorin 4D in T lymphocytes." Molecular Immunology 129 (2021): 56-62.
[3] Zhang, Lei, Ying Chen, and Ke Wang. "Functions of semaphorin 4D in tumor progression." Chinese Journal of Clinical Oncology 3 (2015): 185-189.
[4] Maleki, Kimia T., Martin Cornillet, and Niklas K. Björkström. "Soluble SEMA4D/CD100: a novel immunoregulator in infectious and inflammatory diseases." Clinical Immunology 163 (2016): 52-59.
[5] Chapoval, Svetlana P. "Neuroimmune semaphorins as costimulatory molecules and beyond." Molecular Medicine 24.1 (2018): 1-20.
[6] Wu, Mingfu, et al. "The role of Sema4D/CD100 as a therapeutic target for tumor microenvironments and for autoimmune, neuroimmune and bone diseases." Expert opinion on therapeutic targets 20.7 (2016): 885-901.
[7] Evans, Elizabeth E., et al. "Antibody blockade of semaphorin 4D promotes immune infiltration into tumor and enhances response to other immunomodulatory therapies." Cancer immunology research 3.6 (2015): 689-701.
[8] Masuda, Kenta, et al. "Sema4D stimulates axonal outgrowth of embryonic DRG sensory neurones." Genes to Cells 9.9 (2004): 821-829.
[9] Nkyimbeng-Takwi, EusebiusHenry, and Svetlana P. Chapoval. "Biology and function of neuroimmune semaphorins 4A and 4D." Immunologic research 50.1 (2011): 10-21.
[10] Conrotto, Paolo, et al. "Sema4D induces angiogenesis through Met recruitment by Plexin B1." Blood 105.11 (2005): 4321-4329.
[11] Kumanogoh, Atsushi, et al. "Identification of CD72 as a lymphocyte receptor for the class IV semaphorin CD100: a novel mechanism for regulating B cell signaling." Immunity 13.5 (2000): 621-631.
[12] Nishide, Masayuki, and Atsushi Kumanogoh. "The role of semaphorins in immune responses and autoimmune rheumatic diseases." Nature Reviews Rheumatology 14.1 (2018): 19.
[13] Nojima, Satoshi, and Atsushi Kumanogoh. "Semaphorins in the immune system." Semaphorins. Springer, Tokyo, 2015. 137-157.
[14] Alves, Chrystian Junqueira, et al. "Plexin-B2 is a key regulator of cell mechanics during multicellular organization." bioRxiv (2019): 792077.
[15] Takegahara, Noriko, Atsushi Kumanogoh, and Hitoshi Kikutani. "Semaphorins: a new class of immunoregulatory molecules." Philosophical Transactions of the Royal Society B: Biological Sciences 360.1461 (2005): 1673-1680.
[16] Ch'ng, Ewe Seng, and Atsushi Kumanogoh. "Roles of Sema4D and Plexin-B1 in tumor progression." Molecular cancer 9.1 (2010): 1-9.
[17] Jones, M. R., et al. "Successful targeting of the SEMA4D pathway indicates novel treatment strategy for metastatic cancer." Annals of Oncology 28.12 (2017): 3092-3097.
[18] Kuklina, Elena. "Semaphorin 4D as a guidance molecule in the immune system." International Reviews of Immunology (2021): 1-6.
[19] Sierra, Jose Rafael, et al. "Tumor angiogenesis and progression are enhanced by Sema4D produced by tumor-associated macrophages." The Journal of experimental medicine 205.7 (2008): 1673-1685.
[20] Smith, Ernest S., et al. "SEMA4D compromises blood–brain barrier, activates microglia, and inhibits remyelination in neurodegenerative disease." Neurobiology of disease 73 (2015): 254-268.
[21] Liu, Bei, et al. "Elevated plasma soluble Sema4D/CD100 levels are associated with disease severity in patients of hemorrhagic fever with renal syndrome." PLoS One 8.9 (2013): e73958.
[22] Negishi-Koga, Takako, et al. "Suppression of bone formation by osteoclastic expression of semaphorin 4D." Nature medicine 17.11 (2011): 1473-1480.
[23] Takada, Hiroyuki, et al. "Semaphorin 4D promotes bone invasion in head and neck squamous cell carcinoma." International journal of oncology 51.2 (2017): 625-632.
[24] Chen, Wu-gui, et al. "Sema4D expression and secretion are increased by HIF-1α and inhibit osteogenesis in bone metastases of lung cancer." Clinical & experimental metastasis 36.1 (2019): 39-56.
[25] Li, Han, et al. "Promotion of Sema4D expression by tumor-associated macrophages: Significance in gastric carcinoma." World journal of gastroenterology 24.5 (2018): 593.
[26] Jiang, Hongchao, et al. "The role of semaphorin 4D in tumor development and angiogenesis in human breast cancer." OncoTargets and therapy 9 (2016): 5737.
[27] Smeester, Branden A., et al. "SEMA4C is a novel target to limit osteosarcoma growth, progression, and metastasis." Oncogene 39.5 (2020): 1049-1062.
[28] Chen, Ying, et al. "VEGF and SEMA4D have synergistic effects on the promotion of angiogenesis in epithelial ovarian cancer." Cellular & molecular biology letters 23.1 (2018): 1-12.
[29] Liu, Huidong, et al. "Semaphorin 4D expression is associated with a poor clinical outcome in cervical cancer patients." Microvascular research 93 (2014): 1-8.
[30] Yang, Yibo, et al. "Association between prognosis and SEMA4D/Plexin-B1 expression in various malignancies: A meta-analysis." Medicine 98.7 (2019).
[31] Dorfman, David M., et al. "The leukocyte semaphorin CD100 is expressed in most T-cell, but few B-cell, non-Hodgkin's lymphomas." The American journal of pathology 153.1 (1998): 255-262.
[32] Binmadi, Nada O., et al. "Plexin-B1 and semaphorin 4D cooperate to promote perineural invasion in a RhoA/ROK-dependent manner." The American journal of pathology 180.3 (2012): 1232-1242.
[33] Ruffolo, Luis I., et al. "Antibody blockade of semaphorin 4D to sensitize pancreatic cancer to immune checkpoint blockade." (2020): 26-26.
[34] Wang, Yukai, et al. "Germline genetic patterns underlying across familial rheumatoid arthritis, systemic lupus erythematosus and primary Sjögren’s syndrome highlight T cell-initiated autoimmunity." Annals of the Rheumatic Diseases (2019).
[35] Basu, Amrita, and Krithika Kodumudi. "Multimodal approaches to improve immunotherapy in breast cancer." (2020): 161-165.











