NRG1:极具潜力疾病治疗靶点,NRG1融合更为罕见致癌基因
日期:2021-02-18 11:18:31
2021年1月7日,美国FDA授予Zenocutuzumab(MCLA-128)快速通道称号,可作为一种潜在治疗选择,用于治疗NRG1基因融合的转移性实体瘤患者。国际学术期刊《Journal of Thoracic Oncology》曾报道NRG1融合基因的治疗后,肿瘤明显缩小的案例 [1-3]。随后,这一肿瘤新靶点逐渐走向大众视野。NRG1融合是一种比较罕见的致癌基因,在多种实体瘤中均被发现,但最近,也有研究显示NRG1在肿瘤中的正向调节作用。无论是损害或保护机制,NRG1都将为肿瘤治疗提供新的方向。那么,什么是NRG1?NRG1融合的作用是怎样的?NRG1在肿瘤中的研究进展如何?今天,我们一起来了解一下。
1. NRG1的结构和功能
NRG1(神经调节蛋白1,又称为ARIA、HRG、GGF、NDF),是表皮生长因子(epidermal growth factor, EGF)家族成员之一,分子量为44 kD [4, 5]。NRG1蛋白质结构主要包括:胞内区结构、跨膜区、近膜序列、胞外的EGF样结构域、免疫球蛋白样结构域和氨基酸序列(图1)。NRG1基因通过选择性启动子的使用和剪接,会形成4个亚型:I型NRG1~VI型NRG1,其中最主要的是I型~III型3种不同的NRG1亚型。所有类型的NRG1都含有α、β两种EGF样结构域。EGF样受体结合域是ERBB受体酪氨酸激酶活化的必要条件,位于胞外结构域的近膜区 [6]。
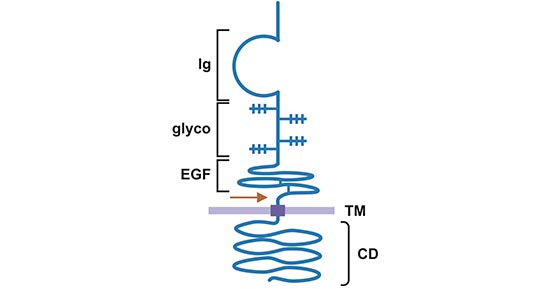
图1. NRG1蛋白结构示意图
*本图来源于Prolactin 出版物[6]。
NRG1主要表达于胶质细胞和神经元以及乳腺、心肌、肺、肾、肝等器官,在神经系统、心肌、乳腺发育中起重要作用 [4, 5]。有研究发现,NRG1β在神经系统、心肌细胞内表达较NRG1α高,而NRG1α在乳腺中的表达较NRG1β高 [7, 8]。此外,越来越多的研究表明NRG1融合与多种肿瘤的发生发展密切相关 [4, 5]。
2. NRG1蛋白的受体
NRG1是EGF配体家族的一员,与ERBB家族受体酪氨酸激酶结合参与细胞的生物学进程 [9]。ERBB受体共有四种:ERBB1、ERBB2、ERBB3和ERBB4。NRG1介导的信号主要经由ERBB2、ERBB3和ERBB4 (图2)[6]。事实上,ERBB受体之间往往形成同二聚体或异二聚体形式,再与配体NRG1发生反应。其中,ERBB2自身无法形成同源二聚体,需要ERBB3或ERBB4的参与形成异源性二聚体,才能与NRG1结合。NRG1作为ERBB的激动剂或配体,与ERBBs结合后,形成二聚体复合物NRG1/ERBBs,激活信号通路 [6, 9, 10]。
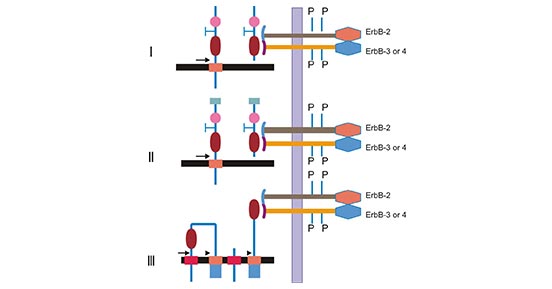
图2. 不同亚型NRG1与受体结合
*本图来源于Prolactin 出版物[6]。
此外,如图3所示,NRG1能与很多其他不同的基因位点融合,比如CD74,SLC3A2,SDC4等,形成新的融合基因后在细胞膜上表达对应的融合蛋白,NRG1基因融合可激活并保留NRG1蛋白的EFG样结构域,使NRG1融合可持续与ERBB受体(ERBB2和ERBB4)成员结合。由此,NRG1融合会导致相关信号通路持续活化,引起细胞增殖失控,导致肿瘤发生 [11]。
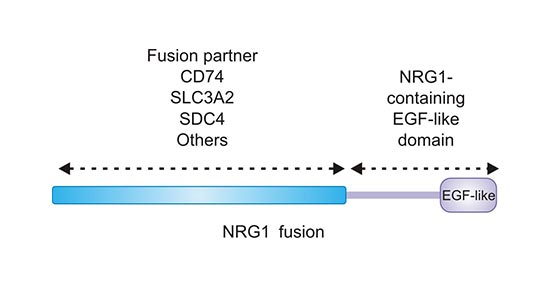
图2. NRG1融合保留NRG1的EGF样结构域
*本图来源于Clinical Cancer Research 出版物[11]。
3. NRG1介导的信号通路
NRG1通过NRG1/ERBBs信号系统,启动了复杂的细胞内信号级联反应,激活细胞外信号调节激酶(ERK)、磷脂酰肌醇3-激酶(PI3Ks)、丝氨酸/苏氨酸蛋白激酶(AKT)、促分裂原活化蛋白激酶(MAPK)、蛋白激酶C(PKC)和Janus激酶和信号转导转录激活因子(JAK-STAT)。NRG1参与这些信号转导途径的活化,引起细胞的增殖、分化和抗凋亡变化,进而发挥其生物学功能 [12]。
如图4所示,在雪旺细胞中,NRG1结合ERBB3/ERBB2异源二聚体,进一步介导细胞内信号转导,激活了多种信号级联,其中包括Ras、细胞外信号调节激酶1/2(Erk1/2)、磷脂酰肌醇-3-激酶(PI3K)/Akt通路、Ca2+的动员、Ca2+依赖性蛋白激酶C(PKC)和NFAT活性。NRG1信号转导途径的活化影响了雪旺细胞的存活、增殖、迁移、分化等活动 [13]。

图2. NRG1结合ERBB3/ERBB2激活下游通路
*本图来源于Academic Press 出版物[13]。
4. NRG1在疾病中的作用
4.1 NRG1和神经相关疾病
NRG1作为一种神经调节蛋白,它可促进神经系统发育,抑制神经元凋亡,还能诱导细胞因子的表达,如果NRG1或NRG1/ERBB发生异常,可能造成神经系统相关疾病,如阿尔茨海默症(AD)、肌萎缩性侧索硬化症(ALS)等 [14]。
NRG1在突触可塑性方面起重要作用,NRG1/ERBB4介导的信号与神经紊乱有关 [15]。此外,NRG1是精神分裂症的易感基因,研究发现,NRG1高表达者发生精神分裂症的几率要高于未表达者 [16]。在周围神经系统的雪旺细胞中,NRG1分泌多种神经因子和生物活性物质为神经轴突再生提供支持和引导。高表达的NRG1使雪旺细胞在神经损伤的再生和修复过程中发挥更大效能 [13]。
4.2 NRG1和心脏相关疾病
除了神经系统,NRG1对于心脏正常发育也必不可少,在心脏的发育及功能维持方面发挥着重要的作用。有研究显示,间歇运动可通过激活心肌NRG1及其受体表达,上调PI3K/Akt蛋白表达,抑制心肌细胞凋亡,改善心脏功能 [17]。
4.3 NRG1和癌症相关疾病
越来越多的研究也表明,NRG1能调控肿瘤细胞的生物学功能,NRG1/ERBBs参与到复杂的调控机制,有时NRG1表达促进肿瘤细胞的增殖、侵袭和转移,但有时NRG1表达的细胞会发生癌细胞凋亡,起到抑制癌细胞生长的作用 [18, 19]。
在正常乳腺细胞中,NRG1表达正常,但在乳腺癌细胞中,NRG1表达极少,研究发现,下调NRG1表达会增加巢状的细胞增殖,提示NRG1在乳腺癌中可能是抑癌基因,NRG1的失活或者缺失可能会诱导乳腺癌的发生发展 [20]。
最近研究发现,在非小细胞肺癌中,靶向抑制NRG1的表达,能促进NSCLC的增殖、侵袭和迁移,提示NRG1对非小细胞肺癌影响存在正向调节作用 [21]。然而在结直肠癌中,研究者发现亚型NRG1 Ⅲ 在结直肠癌中表达上调,可能共同参与了结直肠癌的进展,提示NRG1可作为结直肠癌早期诊断和靶向治疗新的候选靶基因 [22]。
近几年,最引人关注的是,NRG1融合异常导致的肿瘤。有数据表明,NRG1融合发生比例最高的是非小细胞肺癌,同时它还常见于肾癌、甲状腺癌、胆囊癌、膀胱癌、卵巢癌、胰腺癌、乳腺癌、结直肠癌以及肉瘤和神经内分泌癌等癌症中 [23]。这将为更多肿瘤患者提供靶向治疗的机会。
5、NRG1的研发药物及临床前景
NRG1在神经、心脏等器官中起到重要作用。越来越多的证据表明,NRG1的异常表达和NRG1的融合往往会引发神经和心脏功能问题。最新数据显示,美国Salubris研发的NRG1融合抗体药物JK07,适应症为慢性心衰,目前已处于临床I期。这也提示,随着人们对疾病了解的不断加深、抗体技术的不断进化,抗体药在心血管、神经系统疾病、痛风、感染和神经系统疾病等并非传统的抗体药适应症领域也慢慢渗透。
同样值得关注的是,大量研究已证实,NRG1在肿瘤中扮演着两种角色,促癌基因或抑癌基因。NRG1作为一个新星的靶点,其在肿瘤中的作用机制有待进一步探索,目前国内外尚无抗NRG1或NRG1抗体在研的临床药物,具有较大的开发潜力。尤其是NRG1融合的发现,作为一个罕见的致癌驱动基因,目前的研究主要集中在针对这一全新致癌靶点进行的抗体药物开发,比如双特异性抗体Zenocutuzumab(MCLA-128)已获FDA快速通道资格,且在先前接受过治疗的NRG1基因融合胰腺癌患者中表现出了良好的疗效,有望为肿瘤患者带来新的希望。
事实上,抗体药物已经成为治疗肿瘤的重要产品。国内各大药企也将抗体药物作为研发重点,也是药企开拓市场的明星产品。2020年我国抗体药物产业总体市场规模约548亿元,预计2022年扩大至890亿元。随着对NRG1在神经、心脏、肿瘤等机制方面的深入研究,NRG1抗体或抗NRG1抗体或将掀起市场的巨大需求,前景非常广阔。
NRG1蛋白
-SDS.jpg)
(Tris-Glycine gel) Discontinuous SDS-PAGE (reduced) with 5% enrichment gel and 15% separation gel.
-AC1.jpg)
Immobilized NRG1 at 2 μg/ml can bind human ERBB3(CSB-MP007765HU), the EC50 is 18.24-23.66 ng/ml.
参考文献:
[1] Gay, Nathan D., et al. "Durable response to afatinib in lung adenocarcinoma harboring NRG1 gene fusions." Journal of Thoracic Oncology 12.8 (2017): e107-e110.
[2] Muscarella, Lucia Anna, et al. "ALK and NRG1 fusions coexist in a patient with signet ring cell lung adenocarcinoma." Journal of Thoracic Oncology 12.10 (2017): e161-e163.
[3] Cheema, Parneet K., Mark Doherty, and Ming-Sound Tsao. "A case of invasive mucinous pulmonary adenocarcinoma with a CD74-NRG1 fusion protein targeted with afatinib." Journal of Thoracic Oncology 12.12 (2017): e200-e202.
[4] Rimer, Mendell. "Neuregulins at the neuromuscular synapse: past, present, and future." Journal of neuroscience research 85.9 (2007): 1827-1833.
[5] Dammann, Christiane EL, Heber C. Nielsen, and Kermit L. Carraway III. "Role of neuregulin-1β in the developing lung." American journal of respiratory and critical care medicine 167.12 (2003): 1711-1716.
[6] Zhao, Weijiang. "Neuregulin-1 (Nrg1): An emerging regulator of prolactin (PRL) secretion." Prolactin (2013): 83.
[7] Wansbury, Olivia, et al. "Dynamic expression of Erbb pathway members during early mammary gland morphogenesis." Journal of investigative dermatology 128.4 (2008): 1009-1021.
[8] Sithanandam, G., and L. M. Anderson. "The ERBB3 receptor in cancer and cancer gene therapy." Cancer gene therapy 15.7 (2008): 413-448.
[9] Fock, Valerie, et al. "Neuregulin-1-mediated ErbB2-ErbB3 signalling protects human trophoblasts against apoptosis to preserve differentiation." Journal of cell science 128.23 (2015): 4306-4316.
[10] Wadugu, Brian, and Bernhard Kühn. "The role of neuregulin/ErbB2/ErbB4 signaling in the heart with special focus on effects on cardiomyocyte proliferation." American Journal of Physiology-Heart and Circulatory Physiology 302.11 (2012): H2139-H2147.
[11] Dimou, Anastasios, and D. Ross Camidge. "Detection of NRG1 fusions in solid tumors: Rare gold?" Clinical Cancer Research 25.16 (2019): 4865-4867.
[12] Liu, Dawei, and Xinhong Luan. "The Research Progress of Neuregulin 1 in the Reproductive Development." (2015).
[13] Newbern, Jason, and Carmen Birchmeier. "Nrg1/ErbB signaling networks in Schwann cell development and myelination." Seminars in cell & developmental biology. Vol. 21. No. 9. Academic Press, 2010.
[14] Xu, Junping, et al. "Neuregulin-1 protects mouse cerebellum against oxidative stress and neuroinflammation." Brain Research 1670 (2017): 32-43.
[15] Shamir, Alon, et al. "The importance of the NRG-1/ErbB4 pathway for synaptic plasticity and behaviors associated with psychiatric disorders." Journal of Neuroscience 32.9 (2012): 2988-2997.
[16] Munafo, M. R., et al. "Association of the NRG1 gene and schizophrenia: a meta-analysis." Molecular psychiatry 11.6 (2006): 539-546.
[17] Pascual-Gil, S., et al. "NRG1 PLGA MP locally induce macrophage polarisation toward a regenerative phenotype in the heart after acute myocardial infarction." Journal of drug targeting 27.5-6 (2019): 573-581.
[18] Jones, M. R., et al. "Successful targeting of the NRG1 pathway indicates novel treatment strategy for metastatic cancer." Annals of Oncology 28.12 (2017): 3092-3097.
[19] Weinstein, Edward J., Stefan Grimm, and Philip Leder. "The oncogene heregulin induces apoptosis in breast epithelial cells and tumors." Oncogene 17.16 (1998): 2107-2113.
[20] Chua, Y. L., et al. "The NRG1 gene is frequently silenced by methylation in breast cancers and is a strong candidate for the 8p tumour suppressor gene." Oncogene 28.46 (2009): 4041-4052.
[21] Gladstone, E., et al. "MA21. 01 Generation and Characterization of Novel Preclinical Disease Models of NSCLC with NRG1 Rearrangements to Improve Therapy." Journal of Thoracic Oncology 14.10 (2019): S334.
[22] Stahler, Arndt, et al. "Prevalence and influence on outcome of HER2/neu, HER3 and NRG1 expression in patients with metastatic colorectal cancer." Anti-cancer drugs 28.7 (2017): 717-722.
[23] SJonna, Sushma, et al. "Detection of NRG1 gene fusions in solid tumors." Clinical Cancer Research 25.16 (2019): 4966-4972.











