CD38:作为一种多功能的外切酶,为肿瘤免疫治疗提供新策略
日期:2020-12-17 10:27:33
近日,Nature子刊Nature Metabolis收录的两篇抗衰老领域的文章引来了不少关注,研究发现,CD38竟是“不老分子”NDA+消耗的“元凶” [1-2]。我们知道,NAD+是一种与衰老相关的关键代谢物,NAD+含量通常随着机体衰老而降低,其背后的驱动因素,却一直是个谜团。科学家们猜测靶向CD38有望成为人类的休眠开关。尽管这方面尚未得到临床证实,但是另一方面,靶向CD38在肿瘤方面的治疗,已经在临床中发挥重要的价值。如此多功能的CD38,到底是什么,它在肿瘤免疫环境中的机制是怎样的?它为何还与衰老相关?带着疑问,让我们去一起了解探索。
1、CD38的结构和功能
CD38是一种Ⅱ型跨膜糖蛋白,分子量为46kDa。1980年,CD38作为T细胞激活的特异性标记物,被E.L.Reinherz和S.F.Schlossman等科学家发现。CD38整体结构为N末端短的细胞质尾,单次跨膜域和C端较长的胞外区(图1) [3]。CD38具有环化酶和水解酶的活性,是一种双功能胞外酶,参与核苷酸代谢。CD38使用NAD+作为底物来形成环状ADP核糖(cADPR)等核苷酸代谢产物 [4, 5]。核苷酸代谢产物是有效的第二信使,可调节细胞质中Ca2+的动员,激活控制各种生物学过程的信号通路,例如淋巴细胞增殖、胰腺B细胞分泌胰岛素、T细胞活化等 [6]。CD38的这种活性对于维持体内NAD、烟酰胺等物质的动态平衡非常重要。也有研究发现,CD38同CD39、CD73、CD203a等一起,可降解ATP、NAD+、cADPR、AMP,从而产生ADO,诱导抑制性的免疫微环境 [7]。
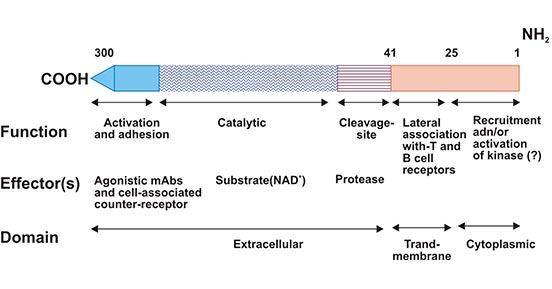
图1. CD38结构
*图片来源于FASEB jouranl出版物[3]。
CD38在人多种组织中都有表达,包括淋巴细胞、自然杀伤细胞、T细胞、B细胞单核细胞/巨噬细胞胰腺、脑、脾脏和肝细胞等 [8, 9]。CD38的表达与多种疾病有关,包括艾滋病、自身免疫性疾病(例如系统性红斑狼疮)、Ⅱ型糖尿病、骨质疏松症和癌症 [10-12]。
2、CD38与非实体肿瘤的关系
CD38在一些非实体肿瘤中高度表达。CD38是慢性B淋巴细胞白血病(B-CLL)的预测因子。临床表明B-CLL患者外周血中单克隆性淋巴细胞多数高表达CD38与不良预后密切相关 [13]。其它非实体瘤,包括巨球蛋白血症(Waldenström’s macroglobulinemia) [14]、原发性系统性淀粉样变(primary systemic amyloidosis) [15]、套细胞淋巴瘤 [16]、急性髓系白血病 [17]、急性淋系白血病 [18]、NK细胞白血病(NK cell leukemia) [20]等,CD38均有较高的表达。
值得关注的是,在多发性骨髓瘤(multiple myeloma,MM)中,CD38在浆细胞有极高的表达,并对免疫有抑制作用 [20]。而在正常淋巴和髓系细胞上,CD38表达少。正是由于这种表达和分布的特异性,使CD38已成为治疗多发性骨髓瘤一个有效靶点。如图2所示,靶向浆细胞表面CD38受体的单克隆抗体,可以触发多种不同的作用机制,促进细胞凋亡和调节免疫反应 [20]。
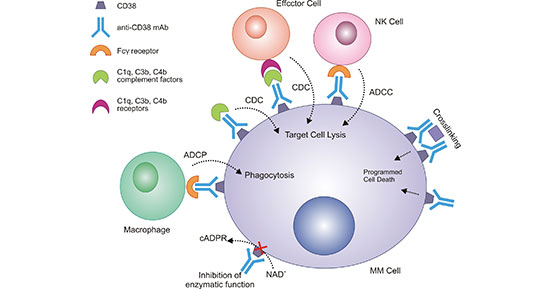
图2. CD38单抗治疗多发性骨髓瘤的作用机制
*图片来源于Frontiers in immunology出版物[20]。
3、CD38与实体瘤的关系
已有研究表明CD38表达水平与腺苷增加密切相关,而腺苷是实体瘤肿瘤微环境中重要的免疫抑制因子 [21]。在某些实体肿瘤中,CD38的高表达可导致肿瘤微环境中产生大量的腺苷,腺苷将招募Treg细胞、MDSC细胞、CAF细胞等免疫抑制细胞,从而抑制免疫系统的活性。此外,腺苷与免疫细胞表面的A2AR受体结合来激活免疫细胞内部的抑制信号通路 [22]。意味着CD38将通过腺苷受体信号传导抑制CD8+T细胞等免疫细胞的活性和功能(图3)。
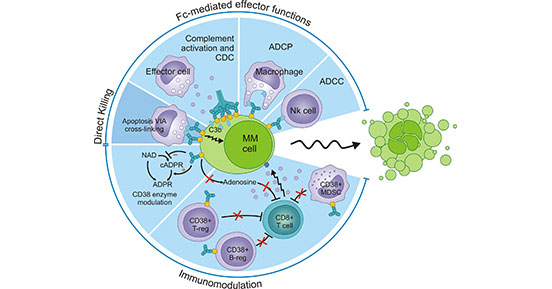
图3. CD38在实体瘤肿瘤微环境免疫抑制信号通路
*图片来源于Successful Drug Discovery出版物[22]。
虽然CD38在实体瘤中的进展有待深入探索,但对黑色素瘤、胶质瘤、食管癌、宫颈癌和肺癌的研究已经开始。在这些疾病中,CD38作为一种肿瘤促进因子发挥作用 [23]。
4、CD38与衰老的关系
在文章开篇所提到的发表在《自然代谢》杂志的两项研究中,作者发现随着细胞的衰老,代谢负担逐渐加重,衰老细胞及其分泌的信号会引发CD38的激活,进而导致NAD+的降解,消耗NAD+的含量(图4) [1]。NAD+广泛分布在人体所有细胞当中,是人最重要的辅酶之一,尤其是对调节细胞衰老和维持机体正常功能至关重要。初步的研究数据表明,在老年动物中阻断CD38的活性可以恢复特定组织中的NAD+水平 [2]。那么,靶向CD38的药物或可为科学家们提供另一种方法来防止人体NAD+的下降,从而抵抗衰老。
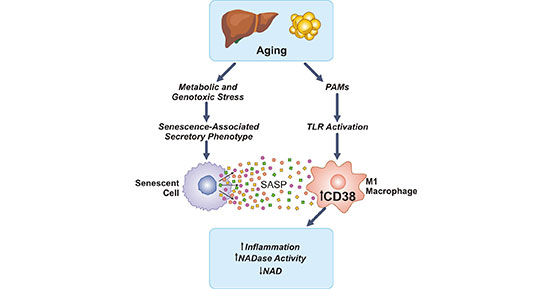
图4. 衰老细胞激活CD38,增加NAD+消耗,引起NAD+水平下降
*图片来源于Nature Metabolism出版物[1]。
5、靶向CD38的研发药物及临床意义
近年来,以CD38为靶点的多种新型免疫治疗方法已在临床前模型和临床试验中得到验证。2015年,强生公司联合开发的全人源抗CD38抗体达雷妥尤单抗(Daratumumab, Darzalex)获准用于治疗复发型、耐药型多发性骨髓瘤患者,是首个上市的CD38抗体药物。
2020年3月2日,赛诺菲研发的抗肿瘤药物Isatuximab获得FDA批准,是继强生Darzalex之后第二款CD38抗体药物,同样是用于治疗复发性难治性多发性骨髓瘤。目前,无论Daratumumab还Isatuximab在多发性骨髓瘤治疗中均体现了显著的疗效。
值得注意的是,目前多家药企包括国内的尚健生物和友芝友生物也开始了CD38抗体药的研发。近日,凯信远达医药CASI Pharmaceutical公司提交了其新型抗CD38单克隆抗体的新药研究申请,用于治疗多发性骨髓瘤。更多的药企正在加入这一竞争队列,详见下表。
| 药物名称 | 研发状态 | 公司 | 适应症 | 更新日期 |
|---|---|---|---|---|
| Isatuximab | 批准上市 | Immunogen Inc; | 多发性骨髓瘤; 阴燃多发性骨髓瘤; 急性淋巴细胞白血病; 急性髓细胞样白血病; |
2020-11-06 |
| Daratumumab/Hyaluronidase-fihj | 批准上市 | 杨森; | 多发性骨髓瘤; | 2020-08-28 |
| Daratumumab(达雷妥尤单抗) | 批准上市 | 杨森; | 多发性骨髓瘤; 淀粉样变; 阴燃多发性骨髓瘤; 急性淋巴细胞白血病; 结外NK-T细胞淋巴瘤; 骨髓增生异常综合征; 淋巴瘤; 套细胞淋巴瘤; |
2020-08-28 |
| MOR-202 | 临床三期 | Morphosys Ag; | 多发性骨髓瘤; 膜性肾小球肾炎; |
2020-08-28 |
| TAK-573 | 临床二期 | Takeda Pharmaceutical Co Ltd; | 多发性骨髓瘤; 非小细胞肺癌; 黑色素瘤; 前列腺癌; 三阴性乳腺肿瘤; 头颈癌; 胰腺导管癌; |
2020-08-28 |
| TAK-079 | 临床二期 | 武田药品工业株式会社; | 特发性血小板减少性紫癜; 重症肌无力; 多发性骨髓瘤; 复发; 系统性红斑狼疮; 自身免疫疾病; |
2020-08-28 |
| FT-500 | 临床一期 | Fate therapeutics, University of Minnesota | 实体瘤 | 2020-09-28 |
| AMG-424 | 临床一期 | Amgen Inc; Xencor; |
多发性骨髓瘤; 复发; |
2020-09-07 |
| STI-6129 | 临床一期 | Sorrento; Therapeutics |
淀粉体轻链淀粉样变性 | 2020-09-27 |
| Anti CD38 chimeric antigen receptor T-cell therapy (Sorrento Therapeutics) | 临床一期 | Celularity; Sorrento Therapeutics; |
多发性骨髓瘤; | 2020-08-28 |
| GBR-1342 | 临床一期 | Glenmark Pharmaceuticals; | 多发性骨髓瘤; | 2020-08-28 |
| Anti-BCMA anti-CD38 bispecific chimeric antigen receptor T cell therapy | 临床一期 | Shengyan Pharmaceutical Technology; 武汉协和医院; |
多发性骨髓瘤; | 2020-08-28 |
| Recombinant human anti-CD38 momoclonal antibody | 临床申请 | 杭州尚健生物技术有限公司; | 血液肿瘤; | 2020-08-28 |
| Y-150(重组抗CD38和CD3双特异性抗体) | 临床申请 | 武汉友芝友生物制药有限公司; | 多发性骨髓瘤; | 2020-08-28 |
| CID-103 | 临床申请 | Tusk Therapeutics; CASI pharmaceuticals | 多发性骨髓瘤; 血液肿瘤; |
2020-08-28 |
*数据来源于药渡
癌症和自身免疫病是抗体药物临床应用的最重要领域。CD38单抗药物的研发从上世纪90年代开始,但目前仅有两款CD38单抗获批上市。根据强生最新财报,2019年Darzalex的全球销售额达到29亿美元。市场调研机构Evaluate Pharma预测,Darzalex 2024年全球销售额有望达到60亿美元。为了应对一个全球每年超过13万新发患者的多发性骨髓瘤,CD38抗体药物的出现为治疗多发性骨髓瘤提供了有力武器。靶向CD38的抗体除了可以对抗肿瘤,在治疗纤维化、代谢紊乱等老化相关疾病中的潜在价值也将不容小觑。因此,CD38靶向药研发正成为大药企不可规避的选项。
参考文献:
[1] Covarrubias AJ, Kale A, Perrone R, et al. Senescent cells promote tissue NAD+ decline during ageing via the activation of CD38+ macrophages [J]. Nature Metabolism. 2020, 2(11):1265-83.
[2] Chini CC, Peclat TR, Warner GM, et al. CD38 ecto-enzyme in immune cells is induced during aging and regulates NAD+ and NMN levels [J]. Nature Metabolism. 2020, 2(11):1284-304.
[3] Mehta, K., Shahid, U., & Malavasi, F. Human CD38, a cell-surface protein with multiple functions [J]. FASEB journal. 1996, 10(12): 1408-1417.
[4] Durnin L, Mutafova‐Yambolieva VN. Cyclic ADP-ribose requires CD38 to regulate the release of ATP in visceral smooth muscle [J]. FEBS. 2011, 278(17): 3095-108.
[5] Chini EN. CD38 as a regulator of cellular NAD: a novel potential pharmacological target for metabolic conditions [J]. Current pharmaceutical design. 2009, 15(1):57-63.
[6] Navazio L, Mariani P, Sanders D. Mobilization of Ca2+ by cyclic ADP-ribose from the endoplasmic reticulum of cauliflower florets [J]. Plant Physiology. 2001, 1; 125(4):2129-38.
[7] Morandi F, Airoldi I, Marimpietri D, Bracci C, Faini AC, Gramignoli R. CD38, a Receptor with Multifunctional Activities: From Modulatory Functions on Regulatory Cell Subsets and Extracellular Vesicles, to a Target for Therapeutic Strategies [J]. Cells. 2019, 8(12):1527.
[8] Glaría E, Valledor AF. Roles of CD38 in the Immune Response to Infection [J]. Cells. 2020, 9(1):228.
[9] Guerreiro S, Privat AL, Bressac L, Toulorge D. CD38 in Neurodegeneration and Neuroinflammation [J]. Cells. 2020, 9(2):471.
[10] Cole S, Walsh A, Yin X, Wechalekar MD, et al. Integrative analysis reveals CD38 as a therapeutic target for plasma cell-rich pre-disease and established rheumatoid arthritis and systemic lupus erythematosus [J]. Arthritis research & therapy. 2018, 20(1):1-4.
[11] Savarino A, Bottarel F, Malavasi F, Dianzani U. Role of CD38 in HIV-1 infection: an epiphenomenon of T-cell activation or an active player in virus/host interactions? [J]. Aids. 2000, 14(9):1079-89.
[12] van de Donk NW, Janmaat ML, et al. Monoclonal antibodies targeting CD 38 in hematological malignancies and beyond [J]. Immunological reviews. 2016, 270(1):95-112.
[13] Dürig J, Naschar M, Schmücker U, et al. CD38 expression is an important prognostic marker in chronic lymphocytic leukaemia [J]. Leukemia. 2002, 16(1):30-5.
[14] Paulus A, Manna A, Akhtar S, et al. Targeting CD38 with daratumumab is lethal to Waldenström macroglobulinaemia cells [J]. British Journal of Haematology. 2018, 183(2):196-211.
[15] Roccatello D, Fenoglio R, Sciascia S, et al. CD38 and Anti-CD38 Monoclonal Antibodies in AL Amyloidosis: Targeting Plasma Cells and beyond [J]. International Journal of Molecular Sciences. 2020, 21(11):4129.
[16] Strati P, Shanafelt TD. Monoclonal B-cell lymphocytosis and early-stage chronic lymphocytic leukemia: diagnosis, natural history, and risk stratification [J]. Blood. 2015, 23; 126 (4):454-62.
[17] Naik J, Themeli M, de Jong-Korlaar R, et al. CD38 as a therapeutic target for adult acute myeloid leukemia and T-cell acute lymphoblastic leukemia [J]. Haematologica. 2019, 104(3):e100.
[18] George AA, Franklin J, Kerkof K, et al. Detection of leukemic cells in the CD34+ CD38− bone marrow progenitor population in children with acute lymphoblastic leukemia [J]. Blood, the Journal of the American Society of Hematology. 2001, 97(12):3925-30.
[19] Mallone R, Funaro A, Zubiaur M, et al. Signaling through CD38 induces NK cell activation [J]. International immunology. 2001, 13(4):397-409.
[20] Morandi F, Horenstein AL, Costa F, et al. CD38: a target for immunotherapeutic approaches in multiple myeloma [J]. Frontiers in immunology. 2018, 9:2722.
[21] Fang C, Li T, Li Y, et al. CD38 produces nicotinic acid adenosine dinucleotide phosphate in the lysosome [J]. Journal of Biological Chemistry. 2018, 293(21):8151-60.
[22] Janmaat ML, van de Donk NW, van Bueren JL, et al. Discovery, Development, and Mechanisms of Action of the Human CD38 Antibody Daratumumab. Successful Drug Discovery. 2018, 3:153-95.
[23] Konen JM, Fradette JJ, Gibbons DL. The Good, the Bad and the Unknown of CD38 in the Metabolic Microenvironment and Immune Cell Functionality of Solid Tumors [J]. Cells. 2020, 9(1):52.
上一篇: CD73,肿瘤免疫治疗的靶点新星











