战疫时刻|产品升级!新冠病毒S纳米抗体助力科研
日期:2020-05-29 14:38:51
新型冠状病毒(SARS-CoV-2)疫情的爆发引起全球范围内广泛关注。截至2020年5月29日,新型冠状病毒已经感染超过590万人,并夺走了超过36万人的生命。
面对持续爆发的疫情,科学界亟需开发安全有效的抗病毒抗体,为抗击新冠病毒提供新型药物和治疗方案。
单克隆抗体(mAb,简称单抗)是医药行业中规模最大、增长最快的领域。在之前的SARS和MERS疫情期间,一些中和单克隆抗体被开发出来,并证实了它们在治疗冠状病毒感染方面的潜力。然而它们的临床使用还是受阻于真核系统的费时费力和昂贵的抗体生产过程以及其分子量大难以运送到特定组织发挥作用的难点。
而针对mAb的一个有吸引力的替代方案是利用骆驼免疫球蛋白制成的单域抗体(Single-domain antibody),也称为VHH或纳米抗体,它们是分子量为12-15 kDa的最小天然抗原结合蛋白结构域。与传统的mAb(分子量为150 kDa)相比,它们的小尺寸提供了一些优势,包括生产成本相对较低,以及在原核生物表达系统中易于在公斤级规模下快速生产。更重要的是,由于纳米抗体的尺寸小、生物物理学特性好,可以通过吸入给药的方式给药,这使得它们特别适用于治疗呼吸系统疾病。
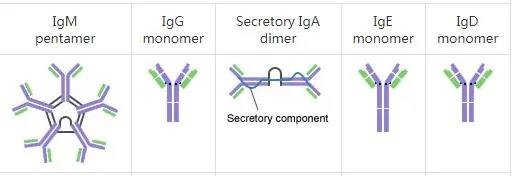
抗体,是成熟的B淋巴细胞分泌的一种蛋白分子,也就是人们常说的免疫球蛋白,呈现“Y”型。人体中共有五种抗体,分别是IgG、IgA、IgE、IgD和IgM。
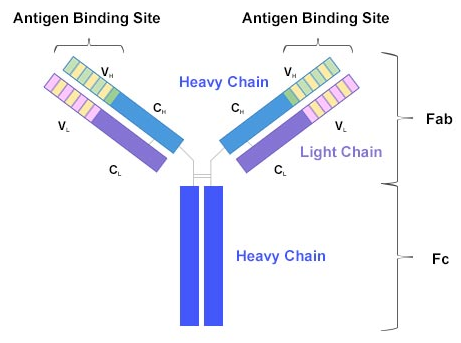
以我们血液中最多的抗体IgG为例,IgG有四条链,两条轻链,两条重链,它们通过二硫键结合在一起。轻链有轻链恒定区(CL)和轻链可变区(VL)。相应地,重链也有重链恒定区(CH)和重链可变区(VH)。与轻链不同的是,重链因为“更长”所以也更“重”,分子量更大。一条重链有三个恒定区,分别是CH1~CH3。
分子量小的抗体可以更方便地运送到病灶,但人血液里抗体IgG比较大,运送比较困难。那么有没有更小的抗体呢?
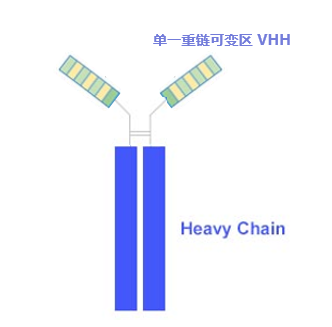
纳米抗体(Nanobodies, Nbs)是由比利时科学家Hamers-Casterman及其团队于1993年在自然杂志中首次报道发现,在骆驼科动物(骆驼,大羊驼,羊驼及其近亲物种)血液中发现有一部分抗体是缺失轻链的“重链抗体”,该抗体只包含一个重链可变区(VHH)和两条重链CH2与CH3区(如图)。这种缺失轻链的重链抗体也能和正常的IgG等抗体一样,去结合抗原。
而单独把这个单一重链可变区(VHH)拿出来其本身也非常稳定,而且能和抗原结合。这就是目前最小的能够结合目的抗原的单位,被称为单域抗体(Single-domain antibodies),VHH晶体为2.5nm,长4nm,分子量只有15 kDa,因此被称作纳米抗体。
与传统抗体相比,纳米抗体具有相对分子质量小、人源化简单、亲和力高、稳定性高、可微生物表达、免疫原性低、可溶性好、渗透力强、可识别隐藏表位等优势。结合了单克隆抗体的理想特性和小分子药物的一些有益特性。
a.相对分子质量小:
传统IgG抗体的大小为150 kDa,纳米抗体为12-15 kDa,是传统抗体的十分之一。
b.人源化简单:
VH和VHH的序列同源性较高,可以看出骆驼体内抗体人源化的FR2区的四个氨基酸突变,对VHH区进行适当的改造即可得到人源化的纳米抗体。
c.亲和力高:
由重链抗体VH和单域抗体VHH的结构可知,VHH的高变区CDR3更长一些,这在与抗原发生特异性结合时更容易且紧密和稳定。
d.稳定性高:
Nbs内部有二硫键的存在,具有最佳的生物物理和生化特性,包括溶解度、耐热性和蛋白水解抗性。
e.可微生物表达:
Nbs是解决单抗生产成本问题的一个很好的选择。由于完全恢复了免疫特异性,Nbs可以在微生物系统(如细菌、酵母菌、真菌)中很容易表达,并且可以从展示文库中快速选择。
f.免疫原性低:
VHH和VH-VL在结构上相似,但是纳米抗体分子量小,其表面的结合部位抗原决定簇少,所以相对于分子量大的抗体来说,纳米抗体的免疫原性相对较低。
g.可溶性好、渗透力强:
深层快速的组织渗透,快速的血液清除。因为纳米抗体(VHH)的框架(FR)区和互补决定(CDR)区域的表征显示FR2区域的疏水性残基突变为亲水性残基(亲水氨基酸:Phe42, Glu49, Arg50, Gly52),传统人类VH (疏水氨基酸:Val42, Gly49,Leu50 Trp52),所以纳米抗体拥有更好的可溶性。此外,纳米抗体(VHH)具有极强的组织渗透力,能够进入致密的组织(如实体瘤)发挥其作用,甚至还可以有效地穿透血脑屏障。
f.识别隐藏的表位:
传统Abs的结晶学研究表明,在大多数情况下,抗原结合面是平的或凹的。相反,Nbs常与裂隙和空腔结合。Nbs的这一特性及其较小的尺寸促进了与传统VH-VL对所不能达到的新表位的相互作用,这也解释了Nbs结合中和传统抗体难以命中的靶点的能力。
2020年5月5日,生命科学领域国际著名杂志Cell在线刊发了美国得克萨斯大学奥斯汀分校Jason S. McLellan、比利时根特大学Xavier Saelens、Bert Schepens等研究人员的研究成果“Structural Basis for Potent Neutralization of Betacoronaviruses by Single-Domain Camelid Antibodies”。该研究发现羊驼体内的抗体有消灭新冠病毒的潜力。注射相应抗原后,羊驼体内产生了两种分别用来对抗MERS和SARS的有效抗体,其中针对SARS的抗体偶联成为双价抗体后具有中和新冠病毒的潜力。不过,目前只是假病毒实验的结果,尚不清楚这种偶联后的抗体是不是在动物中也有保护作用,这都需要后续实验来证实。
这一发现从结构上解析了从羊驼中分离出的单域抗体中和致病性冠状病毒的有效机制,为冠状病毒的治疗提供了潜在的治疗手段。
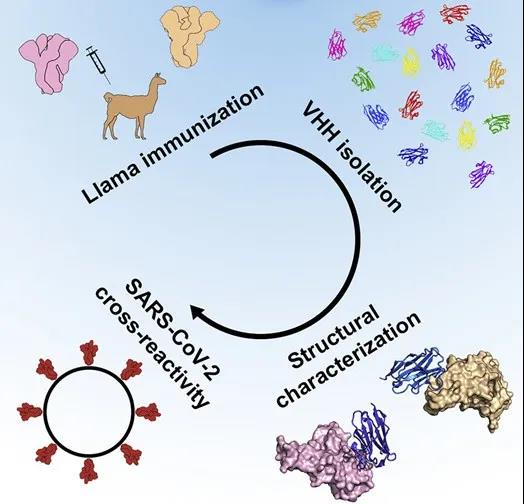
(信息来源:DOI:10.1016/j.cell.2020.04.031)
2020年5月14日,来自中国复旦大学的研究人员在线发表在Cell Host & Microbe期刊上,发表题为“Identification of Human Single-Domain Antibodies against SARS-CoV-2”的论文。科研人员成功地建立一种高效的方法来快速开发SARS-CoV-2特异性的全人源单域抗体,不仅可能在当前的疫情爆发时应对COVID-19,而且还可能加强对未来新型冠状病毒的防范和应对能力。
该研究开发了一个用于快速分离人源纳米抗体的通用平台,并实现了SARS-CoV-2抗体的筛选。纳米抗体不仅可单独使用还能与其他抗体协同作用;小尺寸特征也成为了双特异性或多特异性抗体理想的构建模块,有效阻止病毒逃逸突变的出现等众多优点。因此,这些全人源纳米抗体有望开发成有效的防治药物,应用于新冠肺炎的临床救治。
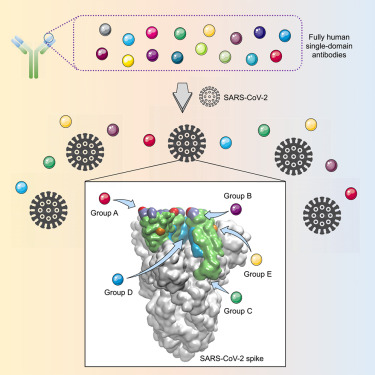
(信息来源:DOI:10.1016/j.chom.2020.04.023)
纳米抗体(VHH)保留了全部的抗原结合能力,被认为是最小的保留完整抗原结合片段,其独特的物理和化学稳定性等为诊断和治疗提供了新的研究工具。在抗体药物研发、医学基础研究以及疾病诊断和治疗方面备受大家的关注。
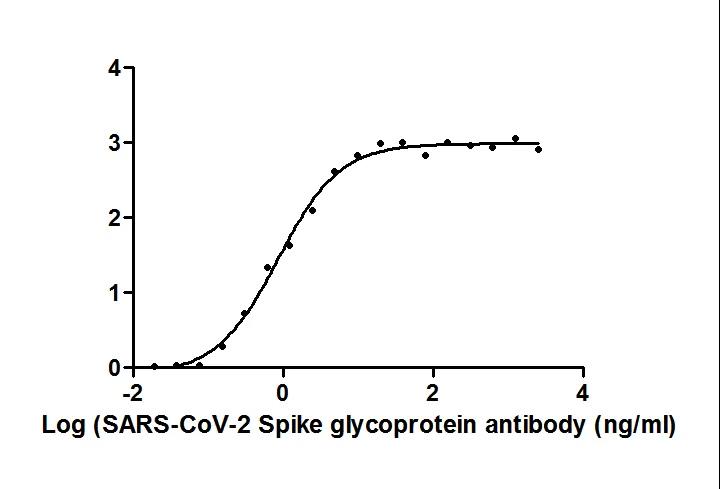
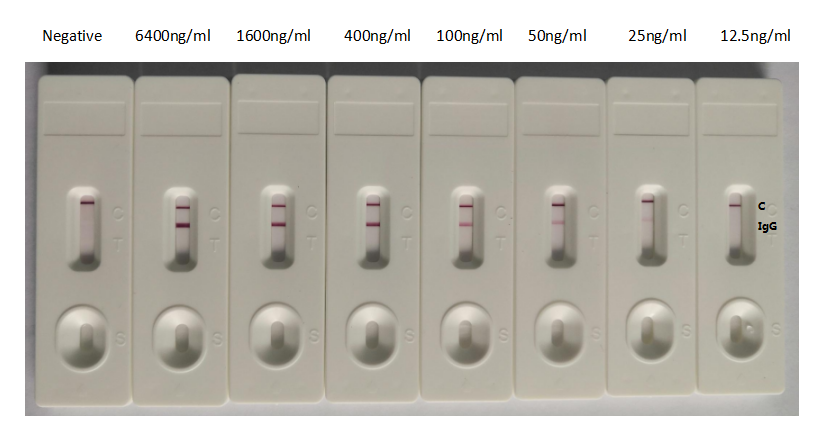
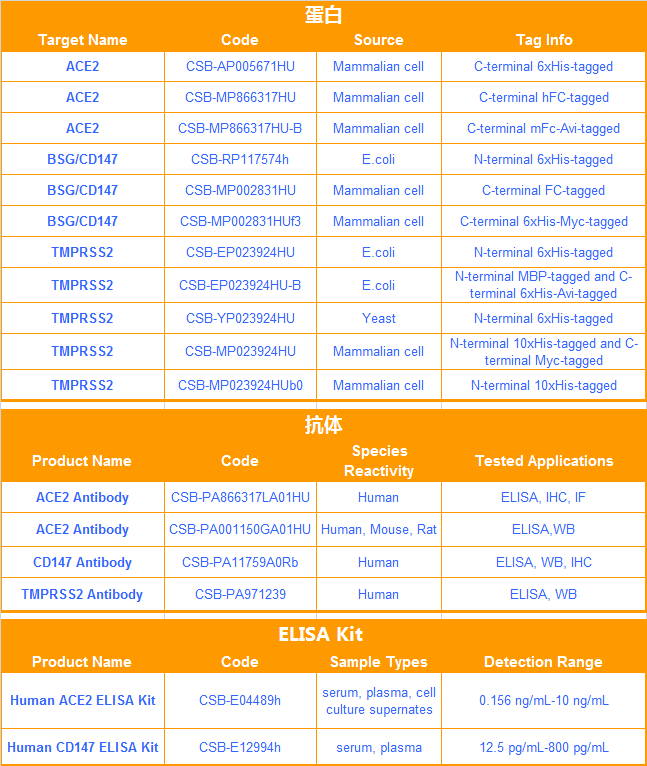
S 纳米抗体产品(活性验证)
种属:Human Novel Coronavirus (SARS-CoV-2/ 2019-nCoV)
抗体亚型:VHH fusion with human IgG1 Fc
应用范围:ELISA, GICA
—END—
——j9九游会登录入口首页生物·让科研变得有温度!——
资源|基础研究数据库汇总
汇总|细胞器标志物通宵整理

上一篇: 战疫时刻|TMPRSS2——新冠病毒入侵的“润滑油”
下一篇: 新品上线|新冠非结构蛋白三品连发!











