同源盒转录因子-NANOG
日期:2019-10-21 16:56:04
胚胎干细胞(embryonic stem cells, ES cells)是从囊胚期内细胞团(inner cell mass, ICM)分离得到的,在体外具有无限增殖、自我更新和多向分化的特性。无论在体外还是体内环境,ES细胞都能被诱导分化为机体几乎所有的细胞类型。鉴于此种特性, ES细胞在临床上具有极其广阔的应用前景。想要将ES细胞成功的应用于临床,必须解决的首要问题是胚胎干细胞是如何实现自我更新及定向分化的。
自从1981年Evans和Kaufman首次成功分离小鼠ES细胞,关于ES细胞的研究一直是研究领域重点及热点。Nanog是2003年5月发现的同源盒转录因子,是一个有助于ES细胞自我更新的关键因子,被认为在ES细胞的全能性维持中起关键作用,在未分化的胚胎干细胞中表达量较高,在分化的胚胎干细胞中表达量较低。它在维持胚胎干细胞的早期胚胎的多功能并阻止其向内胚层分化中发挥十分重要的作用。十年来,关于NANOG的研究层出不穷,关于其结构、功能、作用机制和相关疾病等方面的研究也取得了重要进展。
1. NANOG的结构
目前对Nanog基因研究较多的是小鼠和人源Nanog基因。这里着重介绍下人源Nanog。人源Nanog基因,通常写成Nanog1(Gene ID:13376297),位于12号染色体上,由4个外显子和3个内含子组成,具有915 bp的开放阅读框(ORF)(Figure 1)[1]。非常独特的是,在进化过程中,Nanog1基因已被串联复制成变异基因Nanog2(NanogP1),以及许多假基因(NanogP2-P11)[2] [3]。比较人类和黑猩猩基因组序列发现,Nanog2保留了其内含子序列,而NanogP2至P11是分散的,无内含子和逆转录的整合子[4]。
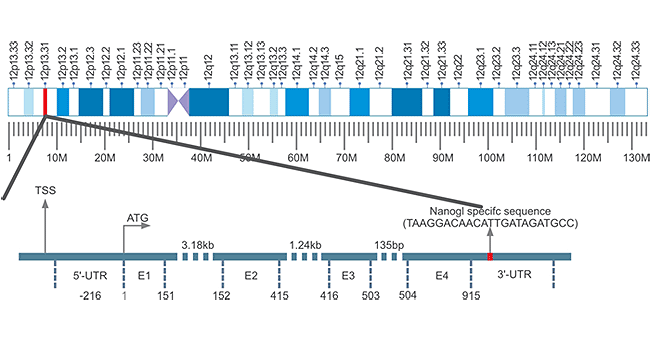
Figure 1. The Structure of Nanog Gene
人源Nanog蛋白是由Nanog1基因编码,包含305个氨基酸和高保守的DNA同源结合区域。Nanog1蛋白结构可大致分为3个区域(Figure 2),一是N端“干扰”域(ND),二是结合DNA的同源域(H),三是C端转录激活域组成。H区含60个氨基酸残基,可与蛋白质相互作用及与DNA(如Oct4)结合;ND区有95个富含丝氨酸和苏氨酸的残基,且在反式作用子中发现酸性残基;C端区含150个氨基酸残基,无明显的转录激活基序,该区域包含2个亚域(CD1和CD2负责反式激活)和一个富含色氨酸的域(WRD)参与二聚化[5]。

Figure 2. The Structure of Nanog Protein
2. NANOG的功能
Nanog主要在胚泡的内细胞团(inner cell mass, ICM)中表达[6]。相关研究表明[7][8],Nanog基因表达与细胞的分裂、分化情况以及细胞的干细胞特性密切相关。在分裂旺盛的细胞中,Nanog基因高表达,而随着细胞分化程度的加深Nanog基因的表达量逐渐降低,直至在完全分化的细胞中不表达。所以,深入研究成体组织中Nanog的表达情况有利于了解成体干细胞的分子生物学特性及其分裂分化机制。
Nanog是2003年才正式鉴定并命名的新基因,在胚胎发育中内细胞团的细胞命运调控方面扮演重要角色,它能维持外胚层的多能性并且能阻止其像原始内胚层的分化。除了维持胚胎干细胞的自我更新和多能性外,Nanog还可以调节ESC的细胞周期。相关报道表明,具有超表达的Nanog的ESC克隆加速了S期进入[9]。此外,Nanog的另外一个功能是在肿瘤发生发展中扮演重要角色,可作为肿瘤诊断标志物。这两个功能将会在作用机制中分别通过与胚胎干细胞和癌症干细胞的关系进行详细阐述。
3. NANOG作用机制
如前所述,NANOG在干细胞自我更新和多能性维持及肿瘤发生发展中至关重要。这里,我们分别从NANOG在干细胞和癌症干细胞中的作用及相关联的互作蛋白对这两个机制进行了阐述。
3.1 NANOG在ESCs中的作用机制
ESC(胚胎干细胞)是胚泡期胚胎的ICM(内部细胞团)衍生的多能细胞。该细胞具有两个独特的特性:无限的自我更新和多能性。ESCs的自我更新和多能性受多种转录因子的控制,其中最常见的是Nanog、Oct4和SOX2。这部分我们重点阐述了NANOG在ESCs中表达调控。
Nanog表达调控仅存在多能细胞中,多能细胞分化后Nanog表达下调。Guangjin Pan等人通过分析Nanog5启动子区域,发现上游180 bp处的转录起始位点-Oct4/Sox2复合结构域在Nanog表达调节中起重要作用(Figure 3)[10] [11]。含有Oct4/Sox2结构域的Nanog近端启动子可驱动报告基因在多能和非多能细胞中适当表达Nanog,而且该结构域在小鼠、大鼠和人之间高度保守。虽然Nanog高表达有利于ESCs自我更新,但Oct4过表达会诱导分化。FoxD3是一个叉头家族转录因子,在小鼠ES细胞和早期胚胎的多能细胞中高度表达[12]。 有报道称FoxD3可与上游270bp处的ESC特异性增强子结合,从而激活Nanog启动子[13]。一开始,研究者们称FoxD3为转录阻遏物,但它仍可以激活Nanog转录,这也表明基因环境可以决定FoxD3调控结果。
从功能上来说,Nanog可以阻止分化,在胚胎发育过程中需要下调Nanog来促进分化。如Figure 3所示,肿瘤抑制因子p53可以与Nanog启动子结合,可在ES细胞分化过程中下调Nanog。但是,当用视黄酸(RA)处理p53-/-ESC时,Nanog在分化过程中仍被下调[14]。这个结果表明ESC分化过程中肯定存在其他调控因子抑制Nanog。Tcf3是在Wnt途径下游起作用的转录因子,在未分化的小鼠ESC中高度表达。小鼠ESC中Tcf3敲除可引起分化延迟,上调Nanog [15]。
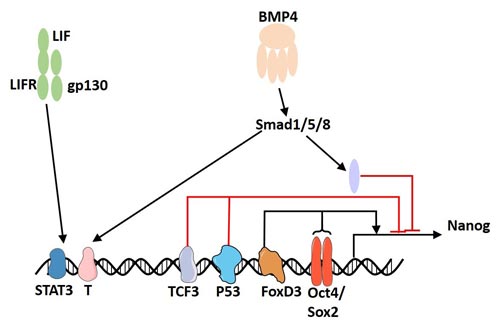
Figure 3. Regulation of Nanog Expression
3.2 NANOG与肿瘤发生发展
自从首次在急性髓性白血病中发现癌症干细胞(Cancer Stem Cell,CSC)后,我们对癌变的认知从根本上发生了改变[16]。癌症干细胞,又称肿瘤干细胞,是指具有干细胞性质的癌细胞,包括“自我复制”以及“多细胞分化”能力。通常这类的细胞被认为有形成肿瘤,发展成癌症的潜力,特别是随着癌症转移出去后,产生新型癌症的来源。相关研究已证实,NanogP8,肿瘤细胞中Nanog1同源物,在调节CSC特性中起关键作用。肿瘤细胞中NANOG的过表达可通过相关信号传导途径对一些重要癌症表型产生影响(Figure 4),包括细胞增殖、细胞迁移与侵袭、耐药性和缺氧应激。
如Figure 4所示,NANOG可由恶性肿瘤中多种刺激因素激活。低氧环境下,NANOG可由HIF-1α或HIF-2α信号通路作用激活[17]。STAT3作为 NANOG下游的靶点,在NANOG介导的免疫逃逸、上皮间充质转化和耐药性中扮演重要角色。而且,NANOG还能够通过活化Akt和TGF-β1调节抵抗CTL介导的裂解作用,同时募集Treg细胞[18]。另外,NANOG可通过上调MDR-1、IGF2BP3和YAP1调节耐药性[19]。此外,NANOG还可以对多个细胞周期调节因子产生影响,其中cyclin D1已被证实直接受NANOG调节[20]。

Figure4. NANOG signaling pathways in human malignancies
4. NANOG与癌症
如前所述,Nanog不仅是维持ESCs自我增殖和亚全能性的关键因子,而且与肿瘤的关系也不简单。因为CSCs和ESCs一样,都具有自我增殖更新能力,而且有多条相同的信号通路。基于此,研究者们推测对Nanog基因的表达调控机制的深入研究有助于探索控制和治疗癌症的新方法[21]。
目前,多项研究已证实Nanog在多种上皮来源的肿瘤细胞、体外培养的肿瘤细胞及异体移植物等都有不同程度的表达,且在肿瘤的表达高于正常组织。Nanog在胚胎瘤细胞、畸胎瘤组织、睾丸原位癌及精原细胞瘤中特异性表达,而正常睾丸中未见Nanog表达[22]。Siu等人发现Nanog在绒毛膜癌细胞中的表达水平显著高于正常胎盘,并且干扰Nanog表达可导致绒毛膜癌细胞系JEG-3凋亡增强[23]。在乳腺癌、胶质瘤、膀胱癌、肺癌及人肉瘤细胞系等体细胞肿瘤中同样发现有Nanog表达,而且肿瘤分化级别越高,其表达越强。另外,沉默Nanog基因可导致细胞周期阻滞,抑制肿瘤发展,同时可诱导肿瘤细胞分化[24]。这些研究结果充分表明,Nanog基因的表达与肿瘤分化状态密切相关,在促进肿瘤细胞的发生发展以及抗凋亡方面具有重要作用,可作为细胞全能性和肿瘤诊断的标志物。
References
[1] Chang DF, Tsai SC, et al. Molecular characterization of the human NANOG protein [J]. Stem Cells. 2009, 27: 812–821.
[2] Eberle I, Pless B, et al. Transcriptional properties of human NANOG1 and NANOG2 in acute leukemic cells [J]. Nucleic Acids Res. 2010, 38:5384–5395.
[3] Scerbo P, Markov GV, et al. On the origin and evolutionary history of NANOG [J]. PLoS One. 2014, 9: e85104.
[4] Wei Zhang, Yi Sui. Insights into the Nanog gene: A propeller for stemness in primitive stem cells [J]. 2016, 12(11): 1372-1381.
[5] GUANG JP, DUAN QP. Identification of Two Distinct Transacti-vation Domains in the Pluripotency Sustaining Factor Nanog [J]. Cell Research. 2003, 13(6):499-502.
[6] Anmstrong L, Hughes O, et al. The role of PBK/AKT, MAPK/ERK and NF-κβ signaling in the maintenance of human embryonic stem cell pluripotency and viability highlighted by transcriptional profiling and functional analysis [J]. Hum Mol Cenet. 2006, 15(11):1894-1913.
[7] Yu J, Vodyanik MA, et al. Induced pluripotent stem cell lines derived from human somatic cells [J]. Science. 2007, 318(5858): 1917-1920.
[8] Hart AH, Hanley L, et al. The pluripotency homeobox gene NANOG is expressed in human germ cell tumors [J]. Cancer. 2005, 104(10): 2092-2098.
[9] Zhang X, Neganova I, et al. A role for NANOG in G1 to S transition in human embryonic stem cells through direct binding of CDK6 and CDC25A [J]. J Cell Biol. 2009, 184: 67–82.
[10] Rodda DJ, Chew JL, et al. Transcriptional regulation of nanog by OCT4 and SOX2 [J]. J Biol Chem. 2005, 280:24731-24737.
[11] Guangjin Pan1, James A Thomson. Nanog and transcriptional networks in embryonic stem cell pluripotency [J]. Cell Research. 2007, 17:42-49.
[12] Sutton J, Costa R, et al. Genesis, a winged helix transcriptional repressor with expression restricted to embryonic stem cells [J]. J Biol Chem. 1996, 271:23126-23123.
[13] Pan G, Li J, et al. A negative feedback loop of transcription factors that controls stem cell pluripotency and self-renewal [J]. FASEB J. 2006, 20:1730-1732.
[14] Lin T, Chao C, et al. p53 induces differentiation of mouse embryonic stem cells by suppressing Nanog expression [J]. Nat Cell Biol. 2005, 7:165-171.
[15] Pereira L, Yi F, et al. Repression of Nanog gene transcription by Tcf3 limits embryonic stem cell self-renewal [J]. Mol Cell Biol 2006.
[16] Hope KJ, Jin L, et al. Acute myeloid leukemia originates from a hierarchy of leukemic stem cell classes that differ in self-renewal capacity [J]. Nat Immunol. 2004, 5:738-743.
[17] Oscar GW Wong and Annie NY Cheung. Stem cell transcription factor NANOG in cancers – is eternal youth a curse [J]? Expert Opinion on Therapeutic Targets. 2015, 1744-7631.
[18] Hasmim M, Noman MZ, et al. Cutting edge: hypoxia-induced Nanog favors the intratumoral infiltration of regulatory T cells and macrophages via direct regulation of TGF-beta1 [J]. J Immunol.
2013, 191:5802–5806.
[19] Yang L, Zhang X, et al. Increased Nanog expression promotes tumor development and cisplatin resistance in human esophageal cancer cells [J]. Cell Physiol Biochem. 2012, 30:943–952.
[20] Han J, Zhang F, et al. RNA interference-mediated silencing of NANOG reduces cell proliferation and induces G0/G1 cell cycle arrest in breast cancer cells [J]. Cancer Lett. 2012, 321:80–88.
[21] Chambers I, Silva J, et al. Nanog safegurads pluripotency and mediates germline development [J]. Nature. 2007, 450(7173): 1230-1234.
[22] Hoei-Hansen CE, Sehested A, et al. New evidence for the origin of intracranial germ cell tumours from primordial germ cells: expression of pluripotency and cell differentiation markers [J]. J Pathol. 2006, 2019(1): 25-33.
[23] Siu MK, Wong ES, et al. Overexpression of NANOG in gestational trophoblastic diseases: effect on apoptosis, cell invasion, and clinical outcome [J]. Am J Pathol. 2008, 173(4): 1165-1172.
[24] Fujii H, Honoki K, et al. Sphere-forming stem-like cell populations with drug resistance in human sarcoma cell line [J]. Int J Oncol. 2009, 34(5): 1381-1386.
上一篇: Oct4--胚胎干细胞多能性的看门人














