【文献解读】辛伐他汀可阻止大鼠中由肝硬化门脉高压导致的慢加急性肝衰竭
日期:2018-08-09 16:07:36
Part I明星产品
产品名称:大鼠中性粒细胞明胶酶相关脂质运载蛋白(NGAL)ELISA Kit
产品货号:CSB-E09409r
种属: Rattus norvegicus (Rat)
检测范围: 0.312 ng/mL-20 ng/mL
灵敏度: 0.078 ng/mL

Part II 文献详情
题目:Simvastatin Prevents Progression of Acute on Chronic Liver Failure in Rats With Cirrhosis and Portal Hypertension辛伐他汀可阻止大鼠中由肝硬化门脉高压导致的慢加急性肝衰竭
期刊:Gastroenterology
影响因子:20.773
研究背景及目的:
细菌感染可加快肝硬化及其临床病变,最终发展成慢加急性肝衰竭(ACLF)。ACLF主要临床表现包括急性失代偿,器官衰竭和短时期内的高死亡率。由于对肝硬化患者ACLF细胞和分子机制知之甚少,因此一直没有有效的治疗手段。在本研究中,Dinesh Mani Tripathi和他的小伙伴们开发了一种与败血症相关的ACLF临床前模型,以便于ACLF发病机制的研究及辛伐他汀抗ACLF作用的评估。
结论:
1、在对肝硬化大鼠的研究中,作者发现LPS可以促进ACLF的发生发展,加重慢性肝病的并发症并减少存活时间。
2、辛伐他汀可减轻LPS诱导的ACLF大鼠的炎症和肝损伤,支持其用于治疗晚期慢性肝病患者。
结果:
- LPS可通过加剧肝内微血管功能障碍、肝脏炎症与氧化应激,同时增加肝星状细胞和中性粒细胞,进一步加重肝硬化大鼠的门静脉高压症。
- 肝硬化大鼠经LPS处理后,其存活时间明显短于肝硬化大鼠对照组。
- 辛伐他汀可预防大多数ACLF并发症并增加存活时间。此外,实验结果还表明,辛伐他汀可增强肝窦功能,降低门脉高压和炎症及氧化指标。
- 该药物显著降低转氨酶,总胆红素和氨的水平,有效抑制LPS介导的肝硬化大鼠肝组织中HSC的活化。
1、外源性给予LPS对肝硬化大鼠的全身作用
本研究中,向肝硬化动物给予外源性LPS可以显着升高内毒素血症,而内毒素血症与全身血液动力学和肾功能障碍息息相关(Suppl. Fig 2)。
2、LPS可加重肝硬化大鼠的门静脉高压症和肝脏微循环功能障碍,而辛伐他汀可预防ACLF的不良反应
与空白组相比,失代偿和代偿性CCl4肝硬化大鼠腹腔注射LPS后,其门静脉压力(PP)呈显著增加趋势,在代偿性TAA肝硬化动物中也观察到相似结果(表1a),但门静脉血流(PBF)有显著变化,因此作者推断ACLF门静脉高压增加是由于肝血管阻力(HVR)增高所致。同样,作者在静脉注射LPS的处理组中也观察到了类似的结果(Supple. Table 3)。另外,在离体肝脏微循环分析中,作者观察到LPS处理组的门静脉灌注压显著增加(Fig 1 top),并且肝血管扩张对乙酰胆碱的反应减弱(Fig 1 bottom),这也进一步证实了肝脏微血管功能障碍会随着ACLF患病时间推移而加重。
ACLF相关潜在干预治疗研究表明,辛伐他汀可以有效的阻止LPS诱导的门静脉高压恶化。如Table 1a所示,与LPS处理组相比,辛伐他汀治疗组的PP明显降低,此时也并未观察到PBF的变化,这也进一步表明HVR降低是PP改善的原因。事实上,在失代偿性CCl4大鼠中,HVR对辛伐他汀的敏感度降低,但这一现象并未在BDL动物中观察到。尽管在CCl4代偿性肝硬化动物中,辛伐他汀处理组的PBF或HVR没有显着变化,但有趣的是MAP却略有改善。这与体内观察到的改善相一致。此外,辛伐他汀还可以防止LPS诱导的ACLF在离体门静脉灌注压(Fig 1 top)和肝血管扩张反应中对乙酰胆碱的血流动力学恶化(Fig 1 bottom)。
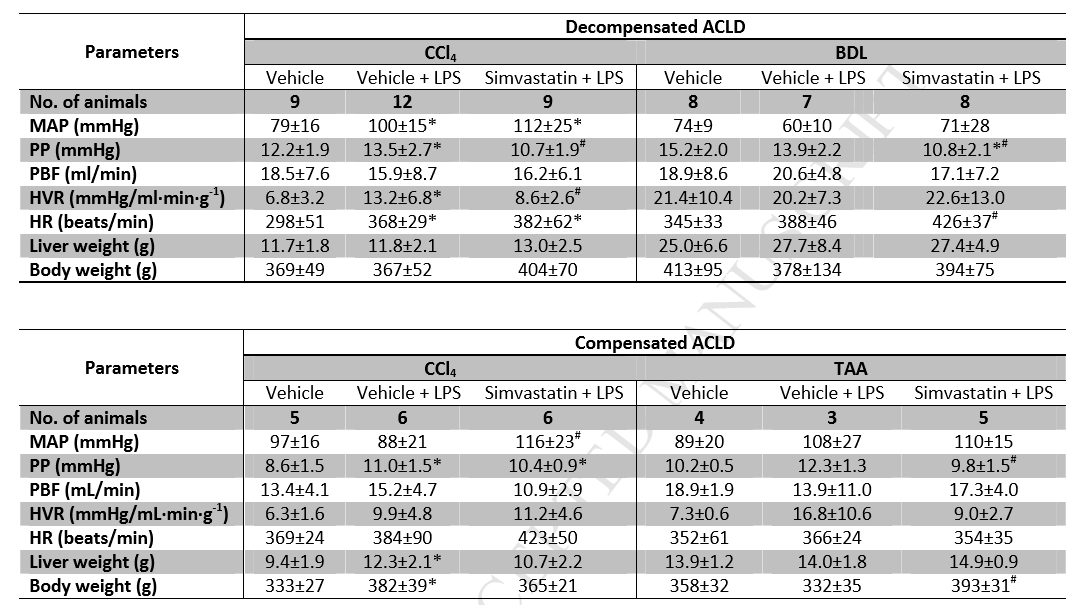
Table 1a LPS和辛伐他汀对失代偿性和代偿性晚期慢性肝病(ACLD)大鼠肝脏和全身血流动力学的影响
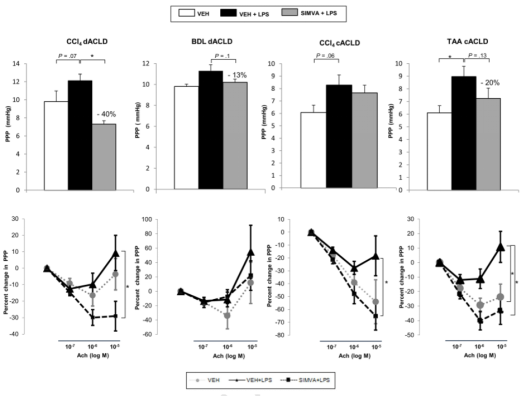
图1:辛伐他汀对晚期慢性肝病(ACLD)大鼠的肝微血管功能的影响
3、他汀类药物可以有效缓解ACLF所引起的验证及氧化应激进一步加剧
如Fig 2,Suppl. Fig 3和Suppl. Fig 4所示,作者通过检测促炎与抗炎因子的变化发现LPS可以显著促进肝硬化大鼠全身和肝脏炎症进一步恶化。同时作者通过观察NETs的形成,发现这种炎性爆发与肝脏中性粒细胞浸润和中性粒细胞活性的显着增加有关(Fig 3和Suppl. Fig 5)。如Fig 2和Fig 3所示,辛伐他汀可预防失代偿性肝硬化大鼠因内毒素血症引起的炎症性爆发,尽管其抗炎作用在BDL临床前模型中不太明显(Fig2-3和supple. Fig 3-4)。在补偿的CCl4大鼠中也观察到类似的趋势(Suppl. Fig 5)。
如Fig 4A-B所示,LPS处理组过氧化物水平显着升高及过氧亚硝酸盐的非显着增加,说明LPS加剧了失代偿性肝硬化大鼠的肝脏氧化应激。有趣的是,氧化解除与肝eNOS活性明显降低有关(Fig 4C-D)。辛伐他汀在失代偿性肝硬化模型(Fig 4A-4B)和CCl4模型(fFig 4C)中均能抑制ACLF所致氧化应激的增加(Fig 4A-4B),并改善P-eNOS/eNOS的比值(Fig 4C),但对BDL模型(Fig 4D)则无明显影响。
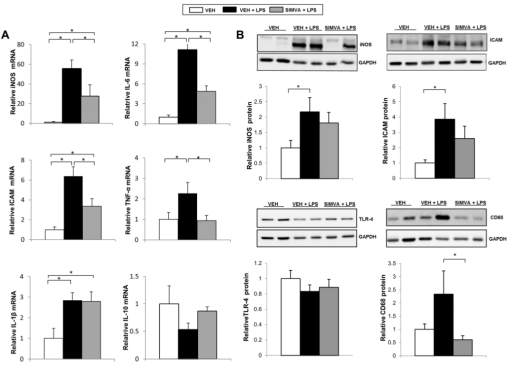
Fig 2. ACLF失代偿性ACLD大鼠的肝脏炎症
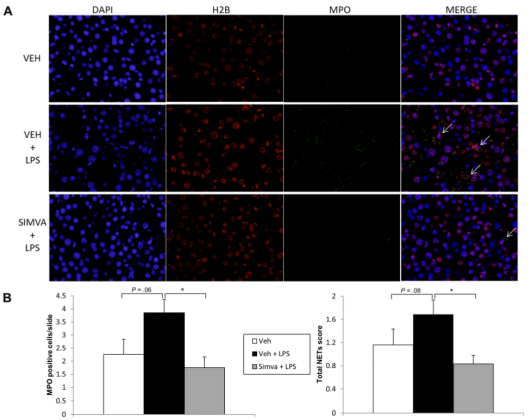
Fig 3. 失代偿期ACLF失代偿性ACLD大鼠中性粒细胞和NETs的检测
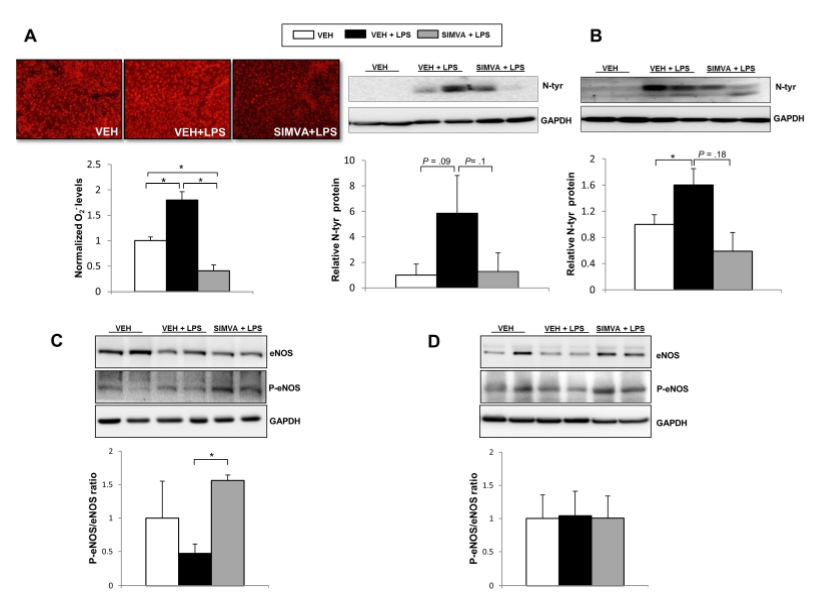
Fig 4. 辛伐他汀对ACLF失代偿性肝硬化大鼠氧化应激和NO通路的影响
4、辛伐他汀可以改善由LPS导致的肝状星性细胞表型恶化现象
通过对ACLF期间肝微循环恶化分子机制的进一步研究,作者发现肝脏中α-SMA蛋白表达和mRNA水平均显著上调,表明内毒素血症可以使失代偿性肝硬化动物HSC急性活化(Fig. 5)。尽管辛伐他汀没有改变肝纤维化(数据未显示),但在两种失代偿的肝硬化大鼠模型中LPS介导的HSC活化都得到了有效的改善。此外,考虑到ACLF期间中性粒细胞浸润增加,作者对LPS激活的中性粒细胞是否影响HSC表型进行了验证。如Suppl. Fig 6 所示,活化的嗜中性粒细胞与LX2细胞的直接共培养会引起HSC过度活化,但在间接共培养却并未观察到HSC过度活化。有趣的是,LPS刺激的中性粒细胞对LX2表型的不利影响却在辛伐他汀的作用下得到了有效改善(Supple. Fig 6),表明在LPS诱导ACLF过程中,中性粒细胞可能部分介导HSC的激活。
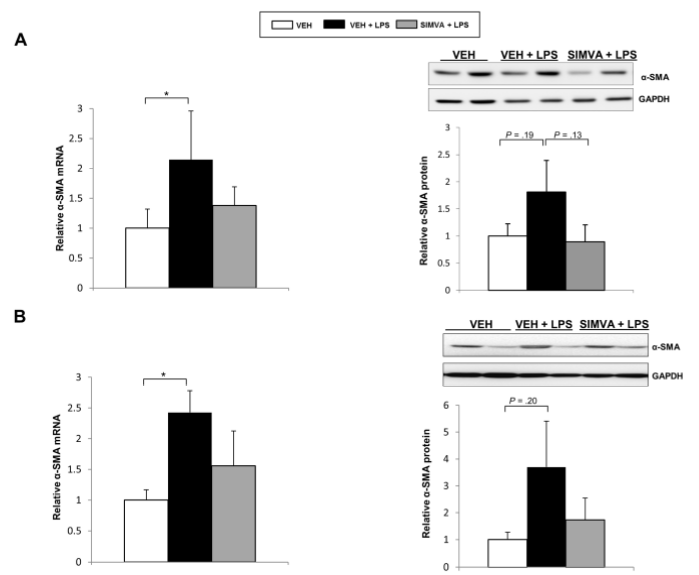
Fig. 5 辛伐他汀对晚期慢性肝病(ACLD)大鼠肝星状细胞表型的影响
5、辛伐他汀可以改善ACLF对肝硬化动物存活率的消极影响
首先,作者对LPS处理后4或24小时(分别在失代偿和代偿性的肝硬化动物中)大鼠存活进行了监测。统计结果显示,非ACLF失代偿和代偿性肝硬化动物无死亡。相反,LPS治疗组,尤其是失代偿性肝硬化模型组死亡率明显高于对照组(Fig 2),如Table 1b所示,通过对存活大鼠中生化指标的监测, LPS可以显著恶化ACLF的作用得到了进一步证实。重要的是,辛伐他汀预处理能有效改善失代偿性肝硬化模型中LPS诱导的ACLF的存活率(Table 2),并显著降低转氨酶、总胆红素和氨含量(Table 1b)。代偿性肝硬化大鼠(Table 1b和Table 2)也有类似的趋势。
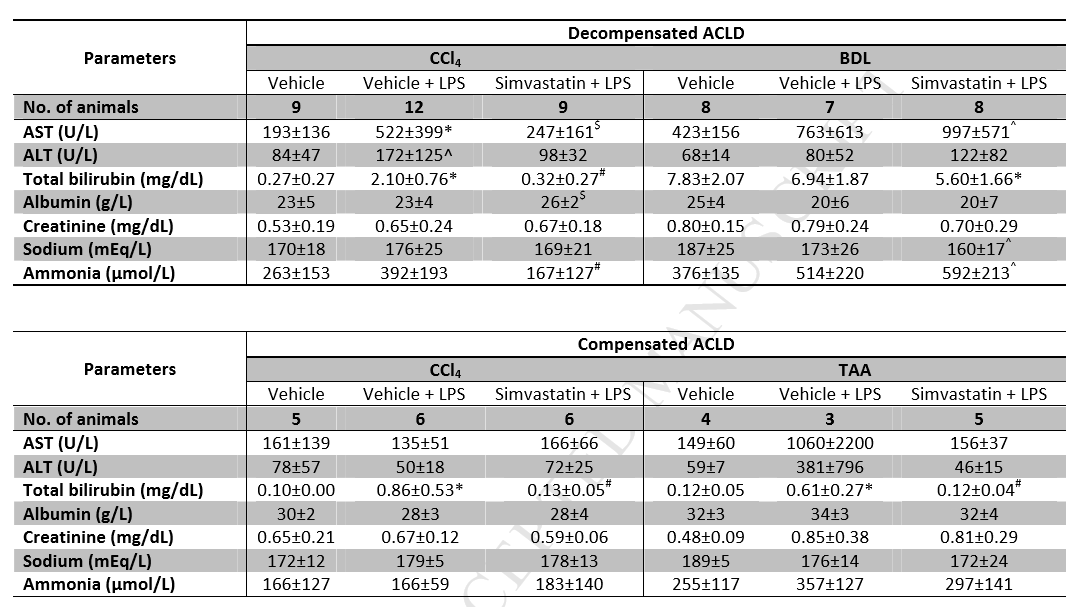
Table 1b LPS和辛伐他汀对失代偿和补偿性ACLD大鼠生化指标的影响
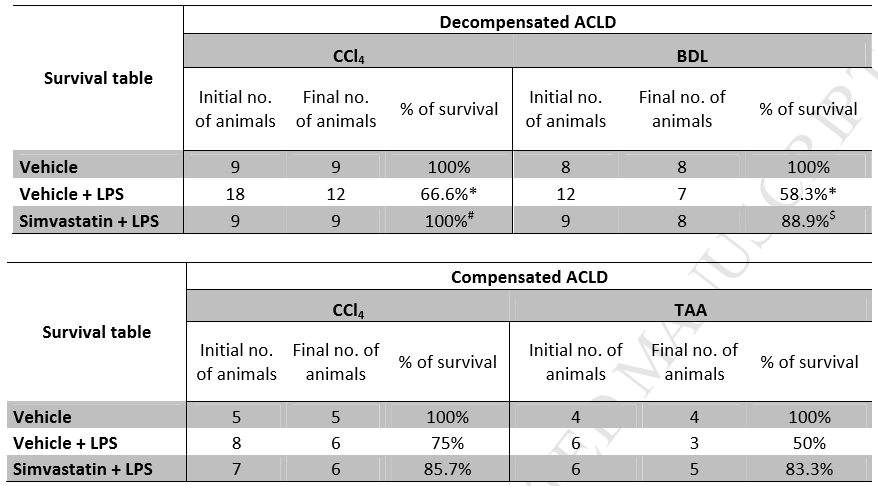
Table 2失代偿和补偿性ACLD大鼠的初始和最终动物数量和存活率
讨论:
由于LPS施用导致的ACLF的发展同时显着加剧肝脏和全身炎症,导致已经功能失调的肝微血管系统的严重恶化和肝硬化动物的存活率明显降低。辛伐他汀主要通过避免炎症性爆发,氧化应激和窦状细胞功能障碍来预防这些失调。综合本次和之前的研究结果,作者建议辛伐他汀作为接受ACLF的肝硬化患者的安全且有用的治疗策略。 实际上,大规模临床试验将评估该化合物对失代偿期肝硬化患者的可能有益作用。











